原发性肝癌转化及围手术期治疗中国专家共识(2024版)
详细信息Chinese expert consensus on conversion and perioperative therapy of primary liver cancer (2024 edition)
More Information-
摘要:
我国目前仍有超过一半的肝癌患者在初诊时即为中晚期,丧失手术切除机会,而部分可手术患者术后复发转移率高,导致患者总体生存较差。随着外科手术技术的革新、系统治疗和局部治疗手段的丰富和进步,通过多模式综合治疗策略为肿瘤转化提供可能、使患者获得手术切除机会,同时有效降低术后复发转移率,从而实现患者长期生存获益。此外,近年来研究者对转化及围手术期治疗过程中手术时机的选择、病灶评估、疗效预测、并发症处理等方面进行了进一步有益探索。在原有共识的基础上修订并更新形成《原发性肝癌转化及围手术期治疗中国专家共识(2024版)》,提出了在肝癌转化治疗和围手术期治疗领域的治疗策略和实施过程需要解决的问题,以期为推动该领域研究和临床实践奠定基础。
Abstract:In China, over half of liver cancer patients are in advanced stage at initial diagno-sis, losing the opportunity for curative surgical resection, and part of resectable patients have a high postoperative recurrence rate, resulting in poor overall survival. Innovations in surgical techniques and advancements in systemic and locoregional treatments have paved the way for novel and multi-combination conversion treatment strategies. These approaches offer selected advanced liver cancer patients the prospect of tumor shrinkage and downstaging, ultimately facilitating surgical interven-tion, so as to achieve long‑term survival benefits. Furthermore, further exploration has been taken in timing of surgery, assessment of lesions, prediction of efficacy, management of complications in the context of conversion and perioperative therapy. Based on previous edition of guideline, the updated Chinese Expert Consensus on Conversion and Perioperative Therapy of Primary Liver Cancer (2024 Edition) aims to collect and summarize current clinical experience of conversion therapy and peri-operative therapy, propose remaining problems that need to be solved in conversion therapy and peri-operative therapy and provide a foundation for further research and development of liver cancer treatment in clinical practice.
-
Keywords:
- Liver neoplasms /
- Conversion therapy /
- Perioperative therapy /
- Consensus /
- China
-
随着《肝癌转化治疗中国专家共识(2021版)》《基于免疫联合靶向方案的晚期肝细胞癌转化治疗中国专家共识(2021版)》《肝细胞癌新辅助及转化治疗中国专家共识》《肝癌术后辅助治疗中国专家共识》的发布,转化及围手术期治疗理念在肝癌治疗的临床实践中被进一步推广应用[1]。经过实践探索,在转化及围手术期治疗方面涌现出更多符合循证医学原则的高级别证据,尤其是适应中国国情的研究成果相继问世。为进一步理清概念、规范治疗,改善原发性肝癌患者预后,中华医学会肿瘤学分会联合中国抗癌协会肝癌专业委员会、中国医师协会外科医师分会、中国医疗保健国际交流促进会肝脏肿瘤学分会等组织全国肝癌领域的多学科专家,修订并更新形成《原发性肝癌转化及围手术期治疗中国专家共识(2024版)》(以下简称共识)。
本共识由执笔专家通过搜索PubMed、EMBASE、Cochrane和中国生物医学文献数据库以及近年来国际会议收录的论文摘要[主要来源于美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)和欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)]等公共数据库,以“肝细胞癌”“转化治疗”“新辅助治疗”“辅助治疗”“围手术期治疗”“经动脉介入治疗”“系统治疗”“局部治疗”“放疗”等作为检索词,将主题词与自由词相结合,进行中英文检索;结合《肝癌转化治疗中国专家共识(2021版)》相关内容、热点问题和近年国内专家实际临床应用情况,对共识进行修订。
本共识证据等级评价及推荐参考国家卫生健康委员会《原发性肝癌诊疗指南(2024版)》,循证医学证据等级评估参照证据评价与推荐意见分级、制定和评价方法学(grading of recommendations,asse⁃ssment,development and evaluation,GRADE)的指导原则,采用《牛津循证医学中心分级2011版》作为辅助工具具体执行证据分级(证据等级1~5),见附录1。在从证据转换成推荐意见的方法上,本共识主要参考GRADE对推荐意见分级的指导原则,同时结合ASCO指南的分级方案对推荐意见分级做了部分修改(附录2)。本共识中将推荐意见分为A(强推荐)、B(中等程度推荐)和C(弱推荐)3个等级。
本共识采用电子投票方式计算共识度。表决意见分为5级:A级为完全同意;B级为同意,但有小修改意见;C级为同意,但有较大修改意见;D级为中立;E级为不同意。共识度%=(A+B)专家位数/所有专家位数×100%。对共识度的权衡应兼顾患者获益(有效性和安全性)方案的可及性和效价比、患者意愿、资源的合理利用以及证据等级等。若共识度≥80%,则视为达成共识并通过;若共识度<80%,则在讨论会现场征询意见,会后执笔专家根据讨论结果形成新陈述,并以函询的方式再次进行投票计算共识度。本共识经讨论初步达成20条共识意见。2023年11月11日,97位专家组成员共同参与讨论会并逐条对相关陈述进行讨论和共识度投票,最终更新共达成18条共识意见。
一、肝癌转化及围手术期治疗现状
原发性肝癌是目前我国第4位常见恶性肿瘤及第2位肿瘤致死病因,严重威胁我国人民的生命和健康[2]。原发性肝癌中75%~85%为肝细胞癌(以下简称肝癌)。外科根治性治疗仍是肝癌实现长期生存最有效的治疗手段。早期肝癌[中国肝癌分期(China liver cancer staging,CNLC)Ⅰa期、Ⅰb期和Ⅱa期]首选手术切除、局部消融、肝移植等根治性治疗,中位生存时间可>5年。然而,肝癌患者术后5年复发转移率高达70%[3]。约64%的中国肝癌患者在初诊时已属于中晚期(CNLC Ⅱb期、Ⅲa期和Ⅲb期)[4]。此类患者预后差,虽有部分患者仍能从手术切除中获益,但绝大多数患者已不适合首选手术切除,需通过转化及围手术期治疗等多学科综合治疗方式,以进一步提高远期生存率。
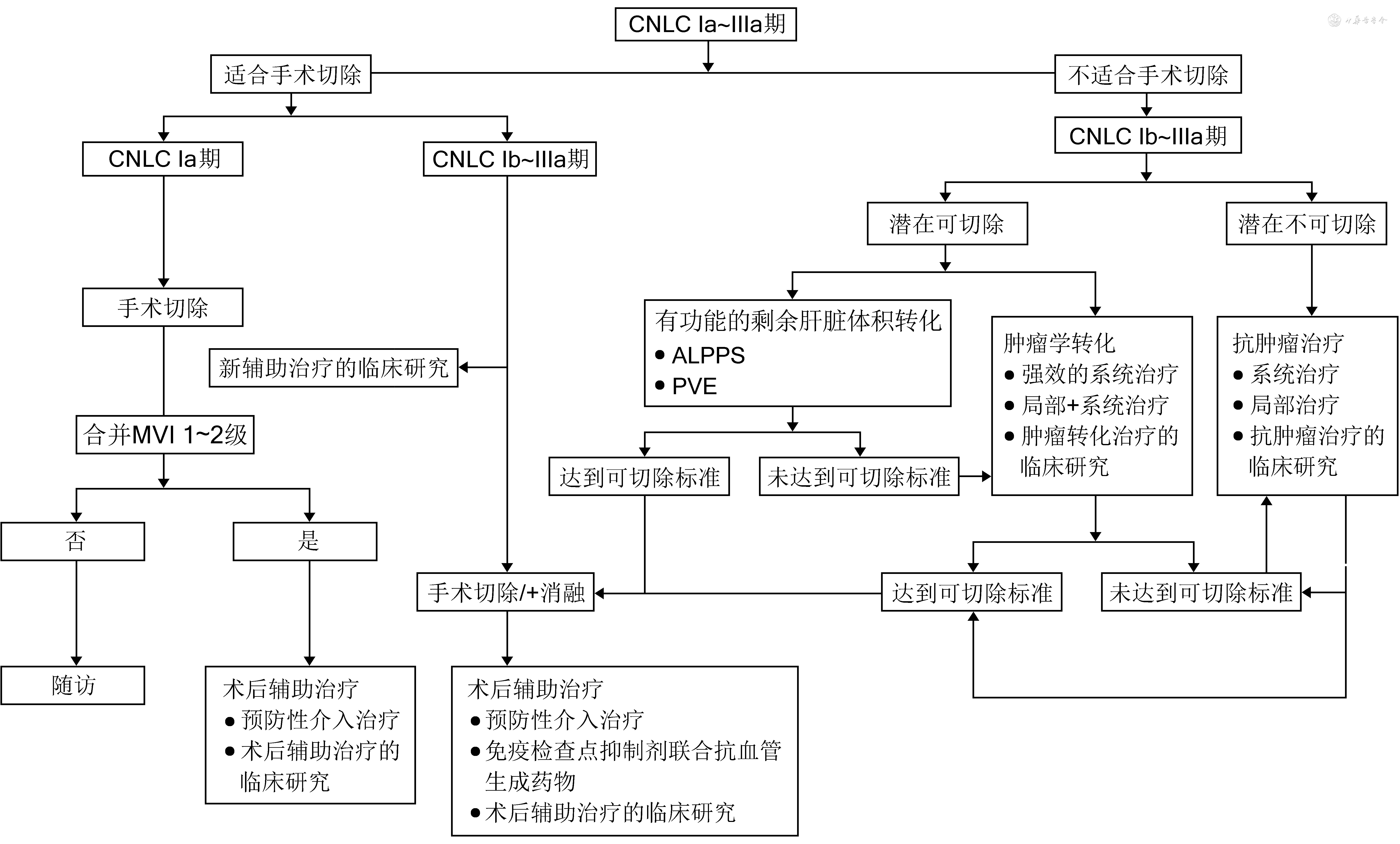
近年来,肝癌的非手术治疗取得显著进展。系统抗肿瘤治疗,特别是靶向药物与免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的联合应用,如阿替利珠单克隆抗体(以下简称单抗)联合贝伐珠单抗(IMbrave 150研究)、信迪利单抗联合贝伐珠单抗类似物(IBI305)(ORIENT‑32研究)、曲美木单抗联合度伐利尤单抗(HIMALAYA研究)、卡瑞利珠单抗联合阿帕替尼(CARES‑310研究)等用于晚期或不可切除肝癌可获得20%~30%(基于RECIST 1.1)的客观缓解率(objective response rate,ORR),中位生存时间提高至约20个月[5]。另一方面,TACE、肝动脉灌注化疗(hepatic artery infusion chemotherapy,HAIC)和放射治疗等局部治疗手段也通过技术和药物的改进、与其他治疗方式的联合,在缩小肿瘤、控制癌栓、改善预后等方面较以往取得更好的效果。基于上述探索,共识编审委员会以多学科参与、多方案共存、多元化结论为特点,结合既有方案以及客观可信的数据,形成肝癌转化及围手术期治疗路线图(图1)。
二、肝癌转化及围手术期治疗相关定义的再认识
转化治疗概念:依据国家卫生健康委员会颁布的《原发性肝癌诊疗指南(2022版)》[2],肝癌手术切除的基本原则包括:(1)彻底性:完整切除肿瘤,切缘无残留肿瘤。(2)安全性:保留足够体积且有功能的肝组织(具有良好血供以及良好的血液和胆汁回流)以保证术后肝功能代偿,减少手术并发症、降低病死率。基于此,能够按照上述基本原则行手术切除的肝癌患者被认为是适合手术切除的患者,反之则不适合手术切除。转化治疗即指不适合手术切除的肝癌患者,经过干预后获得适合手术切除的机会,干预手段主要包括有功能的剩余肝脏体积(future liver remnant,FLR)转化和肿瘤学转化。转化治疗的适用人群主要是CNLC Ⅰb~Ⅲa期、不适合手术切除但具有潜在切除可能的肝癌患者。
围手术期治疗概念:围绕肝癌手术全过程的治疗,其目的是进一步降低肝癌切除术后的复发转移率、提高远期生存率。围手术期治疗主要包括新辅助治疗、术中相关治疗以及术后辅助治疗等。对于明确存在术后高危复发转移风险的患者,如微血管侵犯(microvascular invasion,MVI)、肉眼癌栓、多发肿瘤、卫星结节、肿瘤长径>5 cm、邻近脏器受累等,建议行积极的围手术期治疗。新辅助治疗的适用人群主要是CNLC Ⅰb~Ⅲa期适合手术切除但具有术后高危复发转移风险的肝癌患者。术后辅助治疗的适用人群依据临床特征、术后病理学及分子分型等综合判定。
转化治疗与围手术期治疗两者是内在统一的,其实质或最终目的都是为了实现患者的治愈性转化,从而使患者获得长期无瘤生存。
共识1:转化治疗指不适合手术切除的肝癌患者,经过干预后获得适合手术切除机会,干预手段主要包括有功能的FLR转化和肿瘤学转化。
共识2:围手术期治疗指围绕肝癌手术全过程的治疗,其目的是为了进一步降低手术切除术后的复发转移率、提高远期生存率,主要包括新辅助治疗、术中相关治疗以及术后辅助治疗等。
三、肝癌转化治疗中有功能的FLR转化
实施手术切除的必要条件包括:肝功能Child⁃Pugh A级、ICG R15<30%;FLR须占标准肝脏体积(standard liver volume,SLV)的40%以上(伴有慢性肝病、肝实质损伤或肝硬化者)或30%以上(无肝纤维化或肝硬化者)。有肝功能损害者,则需保留更多的FLR。有功能的FLR不足是肝癌外科学无法手术切除的重要原因。对于这类患者,转化治疗的目标就是将有功能的FLR不足转变为有功能的FLR足够[2,6]。
(一)门静脉栓塞术(portal vein embolization,PVE)
PVE是指经门静脉栓塞肿瘤所在的半肝,使剩余肝脏代偿性增生后再切除肿瘤的一种治疗方式,其转化成功率为60%~80%,并发症发生率为10%~20%。PVE后剩余肝脏增生耗时相对较长(通常需4~6周),约有>20%的患者因等待增生期间肿瘤进展或有功能的FLR增生不足而最终失去手术机会[7‑8]。对于这部分患者,目前的治疗策略有联合TACE、肝静脉栓塞、动脉结扎,以期进一步促进FLR增生并控制肿瘤进展[9]或者行拯救性联合肝脏分隔和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepa⁃tectomy,ALPPS)切除肿瘤[10]。PVE的禁忌证包括门静脉主干或一级分支癌栓,肿瘤广泛转移,合并严重的门静脉高压症和凝血功能障碍。对于预期有功能的FLR增生时间较长(如较严重的肝硬化、年龄较大的患者),肿瘤进展可能较快的患者,需谨慎使用PVE。
(二)ALPPS
ALPPS是近年来肝胆外科领域的重要创新之一,通常可在1~2周诱导产生47%~192%的剩余肝脏增生率,高于PVE,为有功能的FLR不足的患者提供短时期内手术治疗机会。因两期手术间隔时间短,故能最大程度减少肿瘤进展风险,肿瘤切除率达95%~100%[11‑12]。尽管随着手术技术的进步和经验积累,与ALPPS相关的手术并发症及病死率已较ALPPS开展初期减少,但对于并发症的处理仍值得关注。近年来已出现多种ALPPS改进手术方式,主要集中于一期手术肝断面分隔的操作(部分分隔和使用射频消融、微波、止血带等方式分隔)以及采用腹腔镜微创入路行ALPPS,进一步提高了ALPPS手术安全性。ALPPS联合挽救性肝动脉栓塞对于合并轻中度肝硬化的肝癌患者,能够达到近100%的手术切除率[13]。近期的RCT结果显示:ALPPS较PVE在诱导FLR增生的能力方面具有显著优势[14]。ALPPS通常应限定于以下患者:年龄<65岁、肝功能正常(Child‑Pugh A级,ICG R15<20%)、FLR不足(正常肝脏者,FLR/SLV<30%;伴有慢性肝病和肝损伤者,FLR/SLV<40%)、一般状态良好、手术耐受力良好、无严重肝硬化、无严重脂肪变性肝病、无严重门静脉高压症。
共识3:有功能的FLR转化是指针对有功能的FLR不足的肝癌患者,短期内增加有功能的FLR。其具体方式包括ALPPS、PVE,ALPPS较PVE具有较高的转化效率(证据等级2,推荐A)。
四、肝癌转化治疗中的肿瘤学转化
(一)系统抗肿瘤治疗在肿瘤学转化中的应用
肝癌的系统抗肿瘤治疗历经了化疗、靶向、ICIs和靶向免疫联合之路。目前我国已获批用于中晚期肝癌系统抗肿瘤治疗一线适应证的靶向药物包括:索拉非尼、仑伐替尼和多纳非尼;获批的化疗方案为含奥沙利铂的FOLFOX4方案;获批的ICIs包括阿替利珠单抗、卡瑞利珠单抗、信迪利单抗和替雷利珠单抗。鉴于以ICIs为基础的联合治疗方案其近、远期疗效均优于ICIs单药治疗,目前指南和共识一致优先推荐的方案为PD‑1/PD‑L1单抗联合抗血管生成药物以及PD‑L1单抗联合细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte⁃associated antigen‑4,CTLA‑4)单抗[15‑17],相应的联合方案包括阿替利珠单抗联合贝伐珠单抗、信迪利单抗联合贝伐珠单抗类似物、卡瑞利珠单抗联合阿帕替尼、曲美木单抗联合度伐利尤单抗。此外,尚有ICIs联合抗血管生成药物的Ⅲ期临床研究(派安普利单抗联合安罗替尼、特瑞普利单抗联合仑伐替尼或贝伐珠单抗、HLX10联合HLX04、SCT‑I10A联合SCT510等),ICIs联合化疗的Ⅲ期临床研究(卡瑞利珠单抗联合FOLFOX4)以及ICIs联合ICIs的Ⅲ期临床研究(纳武利尤单抗联合伊匹木单抗、信迪利单抗联合IBI310)等正在进行中,部分已完成入组,结果值得期待。
中晚期肝癌系统抗肿瘤治疗的疗效提升进一步促进了早中期肝癌联合治疗模式的发展,系统抗肿瘤治疗已成为转化及围手术期应用的重要手段。通过搜索公共数据库,与转化治疗相关的系统抗肿瘤治疗方案概览见表1。
表 1 中晚期肝癌与系统治疗相关的转化报道概览Table 1. Reports on conversion therapy related to systemic therapy in advanced liver cancer系统抗肿瘤治疗方案 发表年份 样本量(例) 转化成功病例的中国肝癌分期/BCLC分期 治疗周期 客观缓解率 转化率c 单药TKIs 仑伐替尼[18] 2023 5 3例B期/2例C期 3(2~8)个月 3/5a MPR 仑伐替尼[19] 2022 9 2例B期/6例C期 8(4~50)周 2/9a 88% TKIs+免疫检查点抑制剂 信迪利单克隆抗体+仑伐替尼[20] 2023 36 8例B期/4例C期 4.4个月 66.7%a36.1%b 33% 替雷利珠单克隆抗体+仑伐替尼[21] 2023 24 - 4个周期 75.0%a54.2%b 70.8%(3例pCR) PD‑1单克隆抗体+仑伐替尼[22] 2022 107 1例Ⅰa期/3例Ⅰb期/6例Ⅱb期/17例Ⅲa期/3例Ⅲb期 90.5 d 50%b 28%(10例pCR) PD‑1单克隆抗体+仑伐替尼[23] 2023 56 2例B期/29例C期 - 53.6%a44.6%b 55.4% TKIs+PD‑1单克隆抗体[24] 2023 101 3例Ⅰb期/1例Ⅱa期/5例Ⅱb期/11例Ⅱa期/4例Ⅲb期 3.9个月 49.5%a32.7%b 23.8% TKIs+PD‑1单克隆抗体[25] 2022 187 9例Ⅱb期/10例Ⅲa期/10例Ⅲb期 - 37.4%a 15.5% 替雷利珠单克隆抗体+TKIs[26] 2022 44 - - 47.7%b 34.1%(3例pCR) PD‑1单克隆抗体+TKIs[27] 2021 63 1例Ⅰb期/1例Ⅱa期/1例Ⅱb期/7例Ⅲa期 3.2(2.4~8.3)个月 - 15.9%(6例pCR) 纳武利尤单克隆抗体+卡博替尼[28] 2020 1 - 8周 - pCR PD‑1单克隆抗体+仑伐替尼[29] 2020 33 - - 45.5%a 42.4% 大分子抗血管生成+免疫检查点抑制剂 阿替利珠单克隆抗体+贝伐珠单克隆抗体[30] 2023 156 - - 32%b 10.9% 阿替利珠单克隆抗体+贝伐珠单克隆抗体[31] 2023 1 - 15个疗程 - MPR 信迪利单克隆抗体+贝伐珠单克隆抗体类似物[32] 2022 30 13例B期 4.1(2.0~5.7)个月 23.3%b 43.3% 阿替利珠单克隆抗体+贝伐珠单克隆抗体[33] 2022 1 1例C期 7个周期 - pCR 阿替利珠单克隆抗体+贝伐珠单克隆抗体[34] 2021 32 - - - 19% 注: TKIs为酪氨酸激酶抑制剂;PD‑1为程序性死亡[蛋白]‑1;“-”为不能溯源;a基于改良实体瘤疗效评价标准评估;b基于实体瘤疗效评价标准v1.1评估;c除根治性切除外,部分病例还包括根治性射频或根治性经动脉化疗栓塞;MPR为>50%的病理学缓解;pCR为病理学完全缓解;BCLC为巴塞罗那临床肝癌从转化角度考察系统抗肿瘤治疗方案,最重要的考量因素是ORR和缓解方式,包括肿瘤进展率、至缓解时间、病灶缓解持续时间和缓解程度。国内外研究者在转化治疗方案的选择上存在差异。基于药物可及性和强抗肿瘤活性等原因,我国学者大多采纳PD‑1单抗联合酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)的系统抗肿瘤治疗方案(表1)。而在国外临床实践中,部分非病毒相关肝癌可单用仑伐替尼获得转化机会;部分晚期肝癌则采用阿替利珠单抗联合贝伐珠单抗。目前,由于肝癌转化治疗的适用人群标准不一、转化方案不同,转化成功率波动范围大,根据分期路径选择转化治疗的方案尚不成熟。综合表1所述的小样本报道,单从系统抗肿瘤治疗方案选择的角度,需鉴别无法行手术切除的原因,重视病因学的处理,在多学科诊疗模式(multi‑disciplinary team,MDT)框架下,关注肿瘤缓解持续时间和缓解程度,密切观察系统抗肿瘤治疗的毒性及其对转化后手术切除的可能影响,积极探索转化治疗前后肿瘤免疫微环境的变化,积极开展具有高级别循证医学证据的大型临床研究,力争使患者最大程度获益。
共识4:抗血管生成药物联合ICIs是肝癌转化治疗的重要手段(证据等级3,推荐A)。建议在MDT框架下,关注肿瘤缓解的持续时间和缓解程度,密切观察系统抗肿瘤治疗的毒性及其对转化后手术切除的可能影响(证据等级3,推荐B)。
(二)经动脉介入治疗在肿瘤学转化中的应用
1 TACE
TACE是针对中晚期不可切除肝癌常用的治疗方法,也是有效的肝癌转化传统治疗手段。目前TACE术中化疗药物的选择广泛,建议根据患者的肿瘤负荷、体表面积、既往用药及合并疾病等情况选择配伍与用量[35]。此外,除了传统TACE以外,药物洗脱微球TACE的出现,使得在栓塞血管的同时能缓慢持久地释放化疗药物,并在中晚期肝癌的治疗中发挥着重要的作用[36]。经TACE转化后接受手术切除的患者5年生存率为25%~57%,与初始可切除患者大致相当[37]。1项纳入831例中国肝癌患者的回顾性研究表明,对于其中82例经TACE治疗后获得部分缓解的患者,手术切除组较保守治疗组总生存时间(overall survival,OS)延长(49个月比31个月,P=0.027)、5年生存率提高(26%比10%,P=0.019)[38]。TACE治疗后的ORR(尤其是部分缓解率>90%)是影响序贯外科治疗长期生存的关键因素[39]。多次TACE可能引起肝功能损害,且治疗缓解率下降。有研究结果显示:首次TACE的疗效是影响长期预后的重要因素[40]。若经过连续≥3次TACE治疗后仍处于疾病进展状态,则为TACE抵抗,需及时调整治疗方案。采用精细TACE可以减少TACE异质性,以提高ORR[41]。TACE联合其他局部治疗可进一步提高转化成功率。1项研究纳入接受TACE联合HAIC治疗的初始不可手术切除肝癌患者,其中56.1%的患者肿瘤长径≥10 cm,结果显示:TACE联合HAIC的转化率高于单用TACE(48.8%比9.5%,P<0.001)[42]。另外,TACE联合PVE降低肿瘤负荷同时,促使FLR代偿性快速增生,为转化切除创造条件[43]。
2023年我国1项多中心、回顾性、真实世界研究(CHANCE001)结果显示:对于不可切除肝癌,TACE联合TKIs和PD‑1/PD‑L1单抗治疗的临床疗效优于单用TACE治疗,ORR显著提高(60.1%比32.0%,P<0.001,基于改良RECIST)[44]。LAUNCH研究(NCT03905967)结果显示:仑伐替尼联合TACE相较于仑伐替尼单药可提高晚期肝癌患者的临床获益,仑伐替尼联合TACE组中有26例(15.3%)患者转化为手术切除,其中2例患者获得病理学完全缓解(pathological complete response,pCR)[45]。另1项多中心回顾性研究纳入181例接受TACE联合仑伐替尼及PD‑1单抗治疗的不可切除肝癌患者,其中77例患者成功转化,中位转化时间为4.3个月[46]。2023年ASCO报道的1项前瞻性、单臂Ⅱ期临床试验结果显示:TACE联合多纳非尼及卡瑞利珠单抗治疗不可切除肝癌,ORR为81.3%(基于改良RECIST),转化率为80%[47]。TACE与系统抗肿瘤治疗联合需注意肝功能保护,宜优先选择对肝功能影响小的药物。
共识5:采用精细TACE以提高ORR,同时应适当控制TACE次数,避免多次TACE引起肝功能损害。TACE与其他局部治疗或系统抗肿瘤治疗的联合应用可以进一步提高转化率(证据等级2,推荐A)。
2 HAIC
近年来,我国研究者以FOLFOX方案(氟尿嘧啶+奥沙利铂+亚叶酸钙)为基础的HAIC治疗在中晚期肝癌患者中取得较好疗效。Lyu等[41]报道的1项针对晚期肝癌Ⅲ期临床研究结果显示:HAIC较索拉非尼显示出较高的有效率(ORR:31.5%比1.5%,P<0.001,基于RECIST 1.1)和转化率(12.3%比0.8%)。我国另外1项针对315例不可手术切除肝癌患者(肝内肿瘤长径≥7 cm)的Ⅲ期临床研究结果显示:HAIC组ORR(46%比18%,P<0.001,基于RECIST 1.1)及转化切除率(24%比12%,P=0.002)均优于TACE组[48]。此外,HAIC联合系统抗肿瘤治疗可以进一步提高疗效。1项针对合并门静脉癌栓肝癌患者的RCT结果显示:HAIC联合索拉非尼组OS、无进展生存时间(progression‑free survival,PFS)均较索拉非尼单药组延长,ORR提高(40.8%比2.5%,P<0.001,基于RECIST 1.1),同时联合组的手术转化成功率也高于索拉非尼单药组(12.8%比0.8%,P<0.001)[49]。另1项针对合并Vp3/Vp4门静脉癌栓肝癌患者的Ⅱ期临床研究结果显示:对比索拉非尼,HAIC联合索拉非尼取得较高的ORR(41%比3%,P<0.001,基于RECIST 1.1)[50]。以HAIC治疗为基础,联合靶向和ICIs三联方案的临床研究逐渐增多。1项回顾性研究结果显示:与仑伐替尼单药比较,HAIC联合仑伐替尼和特瑞普利单抗可获得较高的ORR(59.2%比9.3%,P<0.001,基于RECIST 1.1)和较高的转化率(12.7%比0)[51]。2022年ASCO更新的2项三联治疗同样取得了较好的疗效。在1项报道HAIC联合阿帕替尼与卡瑞利珠单抗的Ⅱ期临床研究(TRIPLET)中,ORR达到70.96%(基于RECIST 1.1)[52]。另1项Ⅱ期临床研究中,HAIC联合信迪利单抗和贝伐珠单抗类似物(IBI305)治疗初始不可切除肝癌的ORR则为66.7%(基于改良RECIST),转化成功率为66.7%[53]。2023年ASCO更新的两项回顾性分析结果显示:仑伐替尼+卡瑞利珠单抗联合HAIC的ORR为56.3%(基于RECIST 1.1),转化率为31.25%[54]。仑伐替尼+替雷利珠单抗联合HAIC的ORR为94.4%(基于改良RECIST),转化率为38.9%[55]。2023年ESMO报道的Ⅱ期临床研究结果显示:多纳非尼+信迪利单抗联合HAIC的ORR为80.6%(基于改良RECIST),转化率为58.3%[56]。以上结果或应限定于巨大肝癌、弥漫性肝癌或合并门静脉癌栓的患者,在其他肿瘤负荷的肝癌中,TACE仍为主要的治疗方案。
共识6:对于肿瘤负荷较大或合并门静脉癌栓不可手术切除的肝癌患者,HAIC治疗具有较高的ORR和转化率(证据等级2,推荐B)。目前HAIC治疗推荐的化疗方案为FOLFOX,通常需要连续完成≥4次的疗程。在HAIC基础上联合靶向和(或)免疫治疗,可以进一步提高转化率(证据等级2,推荐B)。
(三)放射治疗在肿瘤学转化中的应用
肝癌对于放射治疗敏感,中等剂量的放疗即可获得较好的肿瘤缓解率。对于不适合手术切除的肝癌患者,接受放疗后如能转化为手术切除,可获得更长的生存时间。2014年韩国Lee等[57]回顾性分析264例肝癌患者行同步放化疗的疗效,结果显示:肝内病灶接受大约DT 45 Gy/25分次放疗,联合使用5‑FU+顺铂化疗,最终有18例患者获得手术切除机会,术后中位OS为40个月。
1项回顾性研究纳入了接受放疗联合HAIC治疗的局部晚期初始不可切除肝癌患者,其中41例(16.9%)患者转化成功后接受手术切除,手术组和未手术组5年总生存率分别为49.6%和9.8%(P<0.001)[58]。近期韩国1项研究收集2005—2016年637例局部晚期肝癌患者行放疗同步HAIC治疗的数据,根据放疗剂量分为<72 Gy组和≥72 Gy组,结果显示:<72 Gy组和≥72 Gy组治疗后转化率分别为12%和20%(P=0.03);转化成功后手术组患者较未手术切除组患者的中位OS显著延长,分别为104个月比11个月(P<0.001)[59]。
放疗可联合靶向及ICIs进行转化治疗。近期,香港大学玛丽医院开展了1项前瞻性研究,探索TACE+立体定向放疗(stereotactic body radiotherapy,SBRT)+PD‑L1单抗(avelumab)序贯治疗不可切除肝癌的结局,12%(4/33)的患者经过三联疗法后,获得了根治性治疗(2例手术、2例消融),术后24个月总生存率为100%[60]。另1项倾向评分匹配分析结果显示:与单独行SBRT的患者比较,SBRT联合仑伐替尼治疗的患者的中位OS(16.8个月比11.0个月,P=0.043)、ORR(54.29%比22.86%,P=0.007,基于改良RECIST)均显著提高,有望成为转化治疗的可选方案[61]。
共识7:在其他局部治疗、系统抗肿瘤治疗的基础上,联合放射治疗,可以进一步提高转化治疗成功率(证据等级3,推荐B)。
五、转化治疗的必要性、时机选择和注意事项
(一)转化成功后手术切除的必要性
转化治疗的意义在于使患者获得手术切除的机会,继而获得较长的无瘤生存时间及OS,缩短药物维持治疗的时间。目前转化治疗研究多以短期获益(如手术切除率、术后复发率等)作为主要观察指标,以长期生存作为主要研究终点的研究不多。部分回顾性研究结果显示:转化切除后的生存率较TACE等姑息性治疗手段长期获益更高,如Fan等[62]的研究显示:肝癌患者经TACE转化切除后1、3、5年总生存率分别为80%、65%、56%。Kulik等[63]发现经动脉放射栓塞(transcatheter arterial radio⁃embolization,TARE)转化切除后患者1、2、3年总生存率分别为84%、54%、27%。Lewandowski等[64]的研究结果显示:采用TACE和TARE两种治疗手段的患者术后无瘤生存时间分别为7.1个月和17.7个月。Shindoh等[65]和Kaneko等[66]发现接受TKIs类药物转化切除患者的无瘤生存时间和OS均显著延长。Zhu等[27]发现经TKIs类药物联合ICIs转化切除后,在中位随访时间达到11个月时,8例患者无瘤生存,且4例已停药。Zhu等[24]对接受TKIs联合ICIs转化切除患者的长期生存进行了随访,在中位随访时间达21.5个月时,接受手术切除组患者的OS长于未接受手术切除组的患者(中位OS:未达到比15.9个月,P<0.001);接受手术切除的患者1、2年总生存率分别为95.8%和95.8%,未接受手术切除的患者1、2年总生存率分别为53.2%和35.8%;24例接受手术切除的患者中,14例(60.9%)患者已停药。但这些回顾性研究可能存在选择偏倚,且对于不可切除肝癌的定义以及手术切除的标准未统一,从而影响生存数据的可比性。Zhang等[23]近期发表的1项前瞻性Ⅱ期临床试验结果显示:仑伐替尼联合PD‑1单抗转化治疗后,12个月的无复发生存(recurrence free survival,RFS)率为47.6%,术后中位OS为31.4个月(95%CI为12.6个月至未达到)。
在接受转化治疗的患者中,已发现强效系统抗肿瘤治疗可实现pCR[27,29,67⁃68]。目前尚无证据支持获得pCR的肝癌患者继续采用非手术治疗后长期生存的数据。但如未行手术治疗,也无法证实患者达到pCR。
对于经过治疗达到影像学缓解的患者,是否需手术亦无定论。目前研究结果显示:大多数出现影像学缓解的患者,即使持续用药也会在1~1.5年左右进展,例如仑伐替尼联合帕博利珠单抗治疗的中位缓解持续时间(duration of response,DoR)为16.6个月[69],贝伐珠单抗联合阿替利珠单抗的中位DoR为18.1个月[5]。总结肠癌肝转移的经验,即使是化疗后影像上消失(影像学完全缓解)的病灶,在持续随访过程中,也有>50%病灶出现复发[70]。因此,预期手术切除可使患者获得更长的无瘤生存时间和OS。此外,转化切除对减少药物暴露和相关的不良反应同样具有重要意义。与化疗比较,靶向联合ICIs治疗的缓解程度可能更高,但治疗后影像学上消失或对比剂填充消失的非活性病灶是否仍需手术切除,需前瞻性的对照研究予以回答。与此同时,还需评估手术切除本身的风险与创伤。
共识8:手术切除是转化成功后患者获得长期生存的重要手段。手术切除不仅可以消灭潜在残留肿瘤细胞,且术后病理学检查可为后续辅助治疗提供指导意见(证据等级3,推荐A)。
(二)转化成功后手术切除的时机
1 基于肿瘤反应选择合适的手术时机
许多学者认为,针对不适合手术切除的患者,一旦达到手术切除标准,就应尽早切除。然而研究结果显示:肝癌转化切除后患者的无瘤生存时间与病理学缓解程度相关,出现病理学缓解的患者术后无瘤生存时间更长[67,71]。因此,转化成功的标志不仅在于是否适合手术切除,还应评估肿瘤缓解程度,后者与术后复发和长期生存更为相关。转化治疗使肿瘤达到客观缓解(缩瘤或者降期)或保持病灶稳定一段时间(如3~4个月),可能是切除后获得较好抗肿瘤学效果的前提条件。
共识9:转化成功的标志不仅在于是否适合手术切除,还应评估肿瘤缓解程度,后者与术后复发和长期生存更为相关(证据等级3,推荐B)。
2 基于安全性选择合适的手术时机
转化治疗的手术时机还应考虑手术的安全性。术前治疗手段不同,转化成功后手术时机也各不相同。针对系统抗肿瘤治疗,少有研究明确术前需停药的时间。小分子靶向药物为持续性用药,目前无明确术前停药时间。根据已有文献报告,术前持续用药不会导致术后并发症发生率增加[72⁃73],部分案例报告中术前停药1周后即可进行手术[74]。贝伐珠单抗半衰期约为20 d,且其抗血管生成作用可能导致手术出血增加并影响伤口愈合[75]。从肠癌肝转移行肝切除的经验来看,针对贝伐珠单抗,术前通常需停药>4周,以保证肝切除的安全性。ICIs治疗常为周期性用药方案,已有文献报告建议肝癌转化手术在最后用药周期结束后的4周内进行[76⁃77]。若在靶向治疗或ICIs治疗用药期间出现药物不良反应,则应在停药直至不良反应恢复至Ⅰ级或正常后进行手术。另外,由于免疫性肝炎可能增加手术死亡风险,因此对于经PD‑1/PD‑L1单抗转化治疗的患者,手术安全性评估时需重点考虑是否存在免疫性肝炎。对于免疫性肝炎的评估,除了常规的ALT和AST等肝细胞损伤指标之外,必要时做肝脏穿刺活组织病理学检查,观察炎症细胞和淋巴细胞浸润,以及肝细胞坏死的情况。目前抗血管生成药物联合PD‑1/PD‑L1单抗治疗对术后肝脏功能以及手术安全性影响的相关研究较少,仍需积累更多数据以确定合理的术前评估策略。Shen等[78]的研究结果显示:与同期直接接受手术切除的肝癌患者比较,接受PD‑1单抗联合TKIs转化后切除的肝癌患者术中出血量更多、住院时间更长,但两组患者术后30 d发病率和90 d病死率相似。Luo等[79]以局部治疗联合TKIs类药物和PD‑1单抗作为转化治疗方案的研究也得出了类似结论。因此,对拟行转化后切除的患者需行精细术前评估和围手术期管理,以保证手术切除的安全性。
既往研究发现:术前TACE可导致肝脏炎症反应,增加术中出血量及手术操作难度[80]。但更多学者指出:在末次TACE与手术间隔时间足够长时,TACE对手术的影响较小,对围手术期的并发症发生率、病死率等无明显影响,并建议术前末次TACE与手术间隔≥4周(中位时间间隔为6周)[81‑82]。尽管TACE后数周内部分患者存在肝周炎性粘连,但其对手术操作及手术短期预后无明显负面影响。在部分TACE联合PVE作为转化治疗的患者中,研究者建议在PVE结束后每2周评估FLR,当FLR及ICG R15达到手术指征时可采取手术[83]。在TACE治疗期间易出现肝功能受损的情况,应在肝功能恢复后进行手术。
门静脉主干癌栓放疗与肝切除手术之间的时间间隔一般为8周,可以最大程度减少肝功能受损、术中出血量及术后肝功能衰竭的发生率[84]。
共识10:手术安全性是转化切除前评估的重要内容,不仅需评估通常肝切除手术必备的安全性检查项目,还需重点评估前期转化治疗对肝脏造成的潜在影响。手术前,小分子靶向药物建议停药>1周,PD‑1/PD‑L1单抗建议停药>2周,贝伐珠单抗建议停药>4周;若行TACE,需在末次TACE治疗4周后进行手术;门静脉主干癌栓放疗与肝切除手术之间的时间间隔通常为8周(证据等级4,推荐B)。
六、转化成功后手术切除的后续治疗
对于转化成功达到手术切除标准的患者,其术前转化治疗方案已被证实确切有效,因此术后首选继续使用原转化治疗方案进行辅助治疗。但术后辅助治疗方案的使用应遵循有效性和安全性并重的原则。结合肝癌转化治疗相关文献报道及其他肿瘤转化治疗经验,若转化治疗方案为多种药物的联合,如靶免治疗,双免疫联合等,应根据患者的体力状况、不良反应及治疗耐受情况,酌情选择原方案或原方案中的部分药物。若转化治疗方案为药物联合局部治疗,因术后靶病灶消失,可考虑术后进行1~2次预防性TACE/HAIC治疗后再予药物治疗维持[79,85],或仅使用原转化方案中的药物治疗并根据实际情况进行药物调整。
对于转化成功手术切除后辅助治疗的持续时间,目前亦缺乏充足的数据。结合可切除肝癌术后辅助治疗研究及目前普遍应用的转化治疗方案无进展生存数据,建议术后辅助治疗持续6~12个月。此外,建议每3个月随访1次,密切观察患者肿瘤标志物及影像学检查变化。若连续2次影像学检查结果显示无肿瘤转移复发,连续3个月肿瘤标志物正常且无上升趋势,可考虑停药。辅助治疗过程中应密切观察不良反应,一旦出现严重不良反应或患者不能耐受,应减药或停药。对于切除肿瘤标本达到pCR的患者,可考虑缩短术后辅助治疗时间。
由于肝癌转化切除后辅助治疗的循证依据不足,鼓励国内有条件的大型医学中心开展符合伦理规范的超指南与共识的有益探索与创新研究。如当前国内正在开展的晚期肝癌转化TALENTOP研究。
共识11:肝癌成功转化后,可继续使用原转化治疗方案进行辅助治疗,但需根据患者体力、不良反应及耐受情况酌情调整方案;建议术后辅助治疗持续6~12个月,且每3个月随访1次;连续2次影像学检查显示无肿瘤转移复发且肿瘤标志物保持正常达3个月且无上升趋势可以考虑停药(证据等级3,推荐A)。
七、未获得成功转化患者的后续治疗
对于中晚期肝癌患者,无论是否能够经过转化治疗而获得手术切除的机会,其治疗的主要目标均为延长患者生存时间,同时关注患者生命质量。经过转化治疗后是否能够获得手术切除机会,不仅取决于肿瘤的缩小,也与肿瘤的位置、患者的肝功能状态、体能状态等密切相关。因此,对于未能够获得转化切除的患者,应根据患者的具体情况,在相关指南的指导下,以高级别证据为基础采用个体化的治疗方案。
对于一线治疗失败的患者(包括肿瘤进展及治疗不耐受),应及时更换为二线治疗方案,也可选择未曾使用过的一线治疗药物,或联合其他治疗模式(如局部治疗等),也可考虑参加临床试验。如一线应用PD‑1/PD‑L1单抗联合贝伐珠单抗,后续可采用仑伐替尼或索拉非尼等TKIs类药物作为进展后的治疗选择[86‑87]。对于一线应用PD‑1/PD‑L1单抗治疗失败的患者,也可联合CTLA‑4抗体治疗[88]。一线治疗如采用TKIs,如索拉非尼或仑伐替尼等,二线可换用瑞戈非尼或阿帕替尼等[89‑91];或换用ICIs治疗,包括卡瑞利珠单抗、替雷利珠单抗、帕博利珠单抗等[92‑94]。对于TACE治疗抵抗或进展的患者,应联合系统抗肿瘤治疗或转换为单独系统抗肿瘤治疗的模式。对于肿瘤部分缓解或稳定但仍无手术切除机会者,可维持目前治疗。对于局部进展的患者,除了转换二线治疗方案外,也可联合局部治疗。同时,对于中晚期肝癌发生疾病进展的患者,也需重视对基础疾病的随访和治疗。如对HBV‑DNA进行密切监测,若发现HBV‑DNA载量水平升高,应及时调整抗病毒治疗药物,换用更高效的抗HBV药物。
共识12:未能成功转化患者的后续治疗,需兼顾基础肝病、前期治疗方式、肿瘤进展特征和患者意愿等因素综合决策。根据疾病进展的方式,及时更换为二线治疗方案,也可选择未曾使用过的一线治疗药物,或联合其他治疗模式,或参加合适的临床研究(证据等级2,推荐A)。
八、围手术期治疗
(一)新辅助治疗
1 新辅助治疗的价值
新辅助治疗是指对于适合手术切除但合并高危复发转移风险的肝癌患者,在术前进行系统抗肿瘤或局部治疗,以期减少术后复发转移的发生率。新辅助治疗的价值已在恶性黑色素瘤、肺癌、乳腺癌等多种肿瘤中得到了证实,其意义在于:(1)早期处理隐匿病灶及微小转移灶,减少术后复发转移风险。(2)改善局部晚期患者的预后。(3)使患者术前体能状况良好,对治疗更耐受。(4)因肿瘤尚未切除,新辅助治疗可促进释放更多肿瘤新抗原,其中免疫治疗疗效更佳。(5)了解肿瘤对药物的敏感性,判断肿瘤生物学行为,为术后辅助治疗方案的选择提供依据。(6)可收集及分析治疗前后组织及血液学标本,有助于更好地开展相关研究,发现与治疗相关的标志物,探索耐药机制等。
2 新辅助治疗适用人群
新辅助治疗适用人群包括适合手术切除但术后合并高危复发转移风险的CNLC Ⅰb~Ⅱa期和部分CNLC Ⅱb、Ⅲa期的肝癌患者,术前评估的高危复发转移因素包括:肉眼癌栓、肿瘤长径>5 cm,多发肿瘤,邻近脏器受累、术前AFP水平较高以及术前血清HBV⁃DNA高载量等。
3 新辅助治疗策略
新辅助治疗有望消灭微小转移灶从而降低术后复发转移风险,但也存在风险,例如:相关的不良反应可能导致手术延迟或失去手术机会、增加术后并发症发生风险、无法进行术后辅助治疗、以及新辅助治疗过程中因肿瘤进展而失去手术机会等。因此,新辅助治疗应严格选择适宜人群,同时根据新辅助治疗的目标选择合适的治疗方案。关于治疗方案的选择,在考虑ORR的同时应考虑选择更高疾病控制率的方案,以免患者因疾病进展而失去手术机会。同时,也应选择相对安全、不良反应小的治疗手段,避免增加并发症的发生风险。新辅助治疗的目的不是缩小肿瘤,而是在提高无复发生存时间的同时不影响手术计划。因此,新辅助治疗的周期应严格把握,通常为1.5~3个月,最长不超过4个月。
肝癌新辅助治疗研究多为小样本Ⅱ期临床试验,高级别循证医学证据有限。中山大学肿瘤防治中心的1项多中心、前瞻性Ⅲ期RCT结果显示:HAIC新辅助治疗超米兰标准的BCLC A/B期肝癌患者,可获得63.6%的ORR(基于改良RECIST);新辅助治疗组OS及PFS均显著改善(3年总生存率:63.5%比46.3%,P=0.016;中位PFS:14.1个月比8.9个月,P=0.017)[95]。Wei等[96]比较术前放疗联合手术治疗与单纯手术治疗CNLC Ⅲa期肝癌患者的疗效,放疗组中17例(20.7%)患者门静脉癌栓从程氏癌栓分型Ⅲ型降到Ⅱ型或从Ⅱ型降到Ⅰ型,术前放疗联合手术治疗较单纯手术治疗OS显著延长(24个月,总生存率27.4%比9.4%,P<0.001)。日本北海道大学将肝癌合并门静脉主干癌栓或一级分支癌栓的患者分为放疗联合手术组和单独手术组,放疗剂量30~36 Gy/10~12次。术后病理学检查结果显示:83.3%(5/6)的门静脉主干癌栓达到pCR;放疗联合手术组的5年生存率为34.8%,单独手术组为13.1%(P=0.035 9)[97]。中国医学科学院肿瘤医院的1项前瞻性Ⅱ期临床研究结果显示:38例中央型肝癌接受调强适形放疗作为新辅助治疗,16例(42.1%)患者部分缓解,22例(57.9%)疾病稳定,无疾病进展患者。13例(34.2%)患者达到主要病理学缓解(major pathologic response,MPR),其中5例(13.2%)pCR。1、3、5年总生存率分别为94.6%、75.4%、69.1%;无进展生存率分别为70.3%、54.1%、41.0%[98]。近年来系统抗肿瘤治疗疗效不断提高,靶向、ICIs或靶免联合方案在新辅助治疗中的探索积极进行,但多为小样本Ⅱ期探索性研究,主要结局指标多为病理学缓解率而非总生存,尚待更多前瞻性多中心临床研究验证。近期,来自复旦大学附属中山医院的1项将卡瑞利珠单抗联合阿帕替尼用于可手术切除的CNLC Ⅰb~Ⅲa期肝癌围手术期治疗的Ⅱ/Ⅲ期序贯研究结果显示:在新辅助治疗患者中,40%的患者可达到MPR[99]。
共识13:新辅助治疗是指对于适合手术切除但合并高危复发转移风险的肝癌患者,在术前进行系统抗肿瘤或局部治疗,以期减少术后复发转移风险。但新辅助治疗也存在风险,应严格选择适宜人群,同时根据新辅助治疗的目标选择合适治疗方案(证据等级2,推荐B)。
(二)术后辅助治疗
1 术后辅助治疗适用人群
术后辅助治疗是降低恶性肿瘤复发,提高远期生存的重要手段。相比于新辅助治疗,术后辅助治疗可根据术后病理及分子分型更进一步精准选择治疗人群及个体化治疗方案,且无延迟手术风险。术后辅助治疗的人群主要是适合手术切除且合并高危复发转移风险的肝癌患者。虽然不同研究定义的因素不同,但术后评估高危复发转移的因素通常包括:肿瘤破裂、肿瘤长径>5 cm、多发肿瘤、MVI、大血管侵犯、切缘阳性或窄切缘、组织分化Edmondson Ⅲ~Ⅳ级等[100‑102]。
2 术后辅助治疗策略
对于具有术后高危复发转移风险的患者,目前尚无国际标准辅助治疗方案。两项RCT结果显示:术后TACE治疗可有效减少复发,延长患者生存[103‑104]。中山大学肿瘤防治中心1项多中心Ⅲ期RCT结果显示:采用FOLFOX‑HAIC可降低合并MVI的肝癌患者复发风险,改善生存[105]。另1项前瞻性多中心Ⅲ期RCT结果显示:中药槐耳颗粒可减少术后复发,延长生存[106]。一项单臂、多中心、前瞻性研究结果显示:术后仑伐替尼单药辅助治疗的中位RFS为19.33个月[107]。中国医学科学院肿瘤医院一项前瞻性Ⅱ期临床研究结果显示:对于窄切缘(切缘<1 cm)的肝癌患者,辅助放疗术后5年总生存率为72.2%,无疾病生存率为51.6%[108]。韩国1项前瞻性多中心Ⅲ期RCT结果显示:对于手术切除、射频消融或无水乙醇注射的肝癌患者,活化CIK细胞治疗可显著延长中位PFS,治疗组和对照组中位RFS时间分别为44个月和30个月[109]。另外,对于HBV感染的肝癌患者,核苷类似物抗病毒治疗有助于降低术后复发,应长期服用[110]。对于病毒性肝炎相关肝癌患者,术后辅助使用聚乙二醇化干扰素,可提高OS及RFS,且不会带来严重不良反应[111]。近年来,系统抗肿瘤治疗在肝癌辅助治疗中的研究不断深入,多项Ⅲ期临床研究正处于积极探索中,例如IMbrave 050研究(阿替利珠单抗联合贝伐珠单抗对比主动监测),JUPIER‑04(特瑞普利单抗对比安慰剂),EMERALD‑2(度伐利尤单抗联合贝伐珠单抗对比安慰剂),KEYNOTE 937(帕博利珠单抗对比安慰剂),CheckMate‑9DX(纳武利尤单抗对比安慰剂),SHR‑1210‑Ⅲ‑325(卡瑞利珠单抗联合阿帕替尼对比主动监测)。其中,IMbrave 050研究结果显示:阿替利珠单抗联合贝伐珠单抗可以减少28%的复发风险[112]。
共识14:对于适合手术切除同时具有高危复发转移风险的肝癌患者,术后可采取抗病毒、TACE、HAIC、靶向联合ICIs、放射治疗以及中药槐耳颗粒等辅助治疗以减少术后复发转移、提高远期生存率(证据等级1,推荐B)。
九、转化及围手术期治疗过程中对病灶的评估
(一)病理学评估
转化及围手术期治疗后手术标本的病理切片一般由病理科医师进行独立评估,评估内容包括与治疗相关的组织学形态比例及残留肿瘤比例。大体取材时对肿瘤主体进行全貌观察,初步评估残留活性肿瘤比例并描述于巨检中。对HE染色切片进行镜下观察,评估肿瘤瘤床非活性肿瘤区域,包括坏死反应、纤维化反应、出血反应、泡沫细胞反应、胆固醇结晶现象、肿瘤浸润淋巴细胞及三级淋巴结构组织学形态,并计算镜下残留活性肿瘤区域比例。评估残留肿瘤比例需分别对退行床(病理学缓解)区域进行百分比评估,以5%为最小增值进行评估,原肿瘤主体减去各种治疗反应比例之和为残留肿瘤比例,即残留肿瘤比例(%)=残留肿瘤区域(1‑退行床)/总瘤床区域×100%。
免疫相关病理应答标准(immunological related pathological response criteria,irPRC)应用于最终手术清扫淋巴结的评估当中。相比于当前应用于淋巴结成分的AJCC分期以及用于新辅助治疗“残留肿瘤负担计算器”的计算方法,irPRC具有更高的分辨率,且提供了一个衡量肿瘤细胞能否实现任何免疫介导的新辅助治疗清除的标准。
转化及围手术期治疗后切除标本取材时,依据影像学及大体所见,存在大片坏死应在大体描述时准确描述出范围及百分比,并拍照。对于肿瘤长径≤3 cm的小肝癌应全部取材;肿瘤长径>3 cm的取材方式:需间隔0.5~1 cm连续剖开,分别记录各切面肉眼所见坏死比例,再选择代表性切面参照七点取材方案充分取材,其他层面选择性取材并拍照。有条件可采用大包埋盒及大切片。另外,治疗后淋巴结及癌栓应全部取材,多结节病灶取材可按照单结节病灶取材模式。
临床上针对肝癌的转化及围手术期治疗方案的效果评估中,生存率及ORR等数据的统计需对患者随访数年时间,而病理学反应评估能在数周或者数月内提供较为准确的早期反馈,还可确定是否需在切除术后进行辅助治疗,更具应用优势。由于肝癌新辅助治疗病理学评估并没有统一的评分标准,依据非小细胞肺癌、恶性黑色素瘤等实体肿瘤的新辅助病理学评估,目前可根据病理学缓解情况将患者分为MPR、pCR。
MPR是指存活肿瘤细胞的比例减少到具有显著临床意义的界值以下,在肺癌研究中常将MPR定义为肿瘤床残留肿瘤细胞减少到≤10%[113],这与肝癌术前经TACE治疗后,肿瘤坏死程度与预后的相关性研究结果相同[39]。但MPR的界值在不同组织学类型中有差异[114],因此肝癌MPR定义尚未确定,通常应至少减少50%以上。建议对初诊为MPR的肿瘤标本进一步扩大取材范围加以明确。肝脏原发肿瘤很少或没有存活肿瘤细胞,而淋巴结/癌栓中有存活转移灶(ypT0、N1、2或3),也可被归类为MPR,但其预后和治疗意义尚不清楚[113]。
pCR定义为原瘤床、脉管癌栓及淋巴结中未见到残留肿瘤组织,指在完整评估切除的标本,包括所有取样的区域淋巴结、癌栓和远处转移灶,并审核所有切片后,没有发现任何存活肿瘤细胞。初步的临床证据显示,获得MPR或pCR的患者术后生存情况优于未获得MPR或pCR的患者,但仍需更多证据积累[67]。此外,如何通过影像学或其他临床指标预测MPR或pCR也是亟待解决的问题。Huang等[115]的研究结果显示:影像学完全缓解不是pCR的必要条件;根据改良RECIST标准的测量方法,术前肿瘤强化面积相比基线缩小≥80%能够较好地预测pCR,联合AFP变化可更好地预测pCR。
共识15:MPR是指存活肿瘤细胞的比例减少到具有显著临床意义的界值以下。pCR的标本应充分取材、谨慎评估。监测影像学和肿瘤标志物的动态变化预测肿瘤的病理学缓解程度是需进一步研究的课题(证据等级3,推荐B)。
(二)影像学评估
CT和MRI检查是判断肝癌转化及围手术期治疗疗效、选择手术时机和判断转化手术可切除性的常规检查方法。MRI检查软组织分辨率高且信号不受碘油影响,与动态增强CT检查比较,MRI检查在判断肿瘤活性范围的准确性上更具优势,同时动态增强MRI检查尤其是使用肝胆特异对比剂对于小肝癌检出率更高[116]。而CT检查空间分辨率高,在巨大肝癌患者中精准计算FLR/总肝体积比及模拟肝切除中的优势明显,可降低转化治疗的手术风险。评估治疗反应时推荐在基线和后续检查中使用相同的影像学检查方法,以减少系统误差。
相比较传统的RECIST 1.1标准,评估肝癌治疗反应更适合使用改良RECIST标准[2]。Seymour等[117]的研究结果显示:改良RECIST标准较RECIST 1.1标准可更好区分肝癌靶向治疗的客观缓解情况,其结果与患者生存相关。同时改良RECIST标准评价肿瘤缓解与病理学改变相关,但是影像学强化组织不能鉴别肿瘤组织与炎症反应,对于预测肿瘤病理学缓解程度有一定的限度,联合血清学AFP、异常凝血酶原、7个miRNA组合等检查有望进一步提高pCR预测的准确性[115]。同时免疫治疗增加了肝癌治疗反应的复杂性,需结合iRECIST标准综合评估。通过影像组学、人工智能等医工结合技术对图像数据进行深入挖掘,提取生物学相关信息,有望实现个体化预测肝癌疗效反应和预后。1项多中心研究结果显示:治疗前基于动态增强MRI检查的影像组学与OS和PFS相关,可用于预测肝癌患者经靶免联合治疗后的疗效[118]。
共识16:优先推荐动态增强MRI检查及改良RECIST标准作为肝癌转化及围手术期治疗疗效的影像学评估方法(证据等级1,推荐A)。
十、转化及围手术期治疗过程中并发症的处理
在应用联合治疗方案作为转化及围手术期治疗方案前,应对患者开展临床检查并评估患者基线情况。治疗过程中应密切观察不良反应及并发症的发生情况,做到及时预防、及时发现和及时处理。靶向药物的常见不良反应包括手足皮肤反应、高血压、腹泻、食欲减退、体质量下降、蛋白尿、以及皮疹、肝功能异常、PLT减少、甲状腺功能减退等[89,91,119⁃120]。使用ICIs时,发生免疫相关不良反应(immune related adverse event,irAE)最常见器官或系统包括皮肤、结肠、肝脏和内分泌系统,其他相对少见但会威胁生命的irAE包括间质性肺炎和免疫性心肌炎。不同ICIs对应的irAE谱不同:CTLA‑4抗体的严重irAE主要为结肠炎,PD‑1/PD‑L1单抗常见严重irAE为间质性肺炎、肝炎和神经毒性[121]。靶向药物与ICIs联合使用时部分不良反应发生率可能增加,例如皮肤毒性、腹泻、乏力、甲状腺功能减退等[122‑124]。ICIs联合贝伐珠单抗常见不良反应包括高血压、AST升高、蛋白尿、乏力等[15]。使用贝伐珠单抗时需警惕出血、穿孔及血栓栓塞等事件的发生。
治疗期间,建议定期观察不良反应。并根据《美国国家癌症研究所不良事件常用术语标准5.0版》(NCI‑CTCAE5.0)《中国临床肿瘤学会(CSCO)免疫检查点抑制剂相关的毒性管理指南2021》、《肝细胞癌分子靶向药物临床应用中国专家共识(2022版)》等相关指南和共识的诊断与治疗原则,对不良反应进行及时诊断和积极治疗,酌情调整药物剂量、暂停或终止治疗[125‑127]。有条件的医学中心可组建不良反应多学科诊断与治疗MDT团队,对不良反应进行多学科管理。
共识17:肝癌转化及围手术期治疗过程中应密切观察不良反应及并发症的发生情况,做到及时预防、发现和处理(证据等级1,推荐A)。
十一、转化及围手术期治疗疗效的预测以及相关机制探索
转化治疗起效是实施转化切除的必要条件,因此在启动转化治疗手段之前,预测患者转化治疗的反应尤为重要。目前尚缺少广泛认可的标志物用于预测靶向治疗、免疫治疗、局部治疗或联合治疗的疗效,但有部分报道可以提供借鉴。
利用患者临床特征、实验室及影像学检查预测系统抗肿瘤治疗的疗效具有一定的临床价值。有报道显示:血清PIVKA‑Ⅱ和转移状态的联合评分[128]、WBC计数与淋巴细胞比例的比值[129]、外周血中幼稚CD8+ T细胞数目[130]、以及患者在接受治疗前的增强MRI或增强CT检查的影像组学数据[118,131],可以预测仑伐替尼联合或不联合PD‑1/PD‑L1单抗治疗的肿瘤缓解程度。
目前贝伐珠单抗与PD‑L1单抗联合已经成为了晚期或不可切除肝癌优选的一线治疗方案。多项报道显示:外周血中的细胞分群可帮助预测患者接受阿替利珠单抗联合贝伐珠单抗的疗效。尽管各研究结果不完全一致,但整体而言,基线或短期治疗后中性粒细胞与淋巴细胞的比值较高的患者肿瘤缓解率低、疾病进展发生率高,PFS和OS短[132‑137]。此外,部分探索性生物标志物研究值得关注。有研究报道:CD274(PD‑L1)的表达、效应性T细胞标志物、肿瘤组织中的CD8+T细胞的密度与良好预后相关;而调节性T细胞与效应性T细胞的比值、磷脂酰肌醇蛋白聚糖‑3(Glypican‑3,GPC3)和AFP的表达水平则与治疗后不良预后相关[138]。血清CD137浓度较高的患者PFS更长;肿瘤组织中M1型巨噬细胞(CD68阳性CD163阴性)浸润密度较高的患者ORR更高、PFS更长[139]。治疗前血清骨桥蛋白和AFP水平较高的患者治疗后评估为疾病进展的比例更高、PFS和OS均较短[140]。但需要注意的是,这些标志物还缺少充分的临床验证。
根据患者肝脏肿瘤的特征可以帮助在TACE和HAIC等局部治疗方法中做出选择。目前临床上存在多项建立在肝脏肿瘤负荷基础上的标准来筛选适合TACE治疗的患者。通常认为,肝脏肿瘤负荷超过up‑to‑7标准(最大肿瘤的最大径与肿瘤数目的累加≤7)或超过six‑and‑twelve标准[141]的患者行TACE治疗的获益较少。适合HAIC和适合TACE的人群存在较大重叠,但两者可以相互补充,可以参考《肝动脉灌注化疗治疗肝细胞癌中国专家共识(2021版)》,在TACE和HAIC之间作出合理选择,从而使肝脏肿瘤病灶达到最大限度的控制。
除肿瘤对治疗方案的敏感性,初始肿瘤负荷也会影响患者接受转化治疗后手术切除的机会。1项回顾性研究表明,具备如下特征的患者有更高的机会在靶免联合治疗后成功转化、从而接受手术切除[25],包括:(1)ECOG PS评分为0~1分,肝功能Child‑Pugh A级。(2)肿瘤局限在某一个肝叶;若对侧的肝叶存在肿瘤,对侧肝叶的肿瘤符合米兰标准(单发肿瘤长径≤5 cm;多发肿瘤<3枚,最大径≤3 cm)。(3)若存在血管癌栓,需对侧门静脉分支无癌栓或者癌栓未延续至肠系膜上静脉,肝静脉癌栓未延续至右心房。(4)无肝外转移。同时符合上述条件的患者,在接受仑伐替尼联合PD‑1单抗治疗后有近50%的机会成功转化、接受手术切除;不符合者手术切除的机会≤10%。在临床实践中,选择符合该标准的患者进行强度较高的系统抗肿瘤治疗,联合或不联合局部治疗,以达到更高的转化切除率;超过该标准的患者后续手术切除的可能性相对较小,应在充分评估治疗对生命质量影响的基础上,将治疗目标设定为延长生存时间。
十二、MDT与转化及围手术期治疗
(一)MDT在肝癌转化及围手术期治疗中的作用
目前用于肝癌转化及围手术期治疗的手段包括局部治疗(经动脉介入、放疗等)及系统性药物治疗等。不同治疗方法存在各自的优劣势,适应证有重叠,且治疗手段的实施常涉及多个学科。肝癌生物学行为异质性高,不同个体肝脏疾病背景以及预后影响因素均存在较大差异。目前关于肝癌转化及围手术期治疗的适用人群、具体方式和方案、手术时机的把握、围手术期治疗维持时间等尚缺乏明确的指引和规范,需在实践中逐步总结经验,不同学科间反复沟通讨论,求同存异形成共识。因此,开展肝癌转化及围手术期治疗过程中MDT的合作及沟通十分重要,可考虑建立相对固定的MDT团队,形成通畅便捷的沟通渠道,以保证可以根据患者的病情变化及时对治疗方案进行调整,使患者最大程度获益。
(二)肝癌转化及围手术期治疗过程中MDT各专业人员的协调分工
肝癌转化及围手术期治疗的短期目标是创造适合手术切除的机会,以及提高手术疗效,预防和减少复发,最终目标是使患者获得高质量长期无瘤生存。在转化及围手术期治疗过程中,各学科医务人员应谨记该目标,遵循肝癌MDT的“三要三不要”原则(要以患者为中心、要以疗效为目的、要以循证医学为依据;不要以自己一技之长决定患者的治疗方案、不要过多的单一治疗、不要以经济利益来决定治疗方案),通过MDT为肝癌患者提供个体化的优化决策。
肝癌转化及围手术期治疗过程中涉及的学科及分工主要包括:
(1)外科:是实施肝癌转化手术及围手术期治疗的主导学科,负责推选适合的患者、判断患者是否具备手术机会、决定手术时机、实施手术以及围手术期处理等。
(2)介入科和放疗科:是实施肝癌转化及围手术期治疗的主要学科,负责为患者实施以经动脉介入治疗或放疗为主的局部治疗,对转化治疗后的非手术患者实施补充治疗。
(3)肿瘤内科:是实施肝癌转化及围手术期治疗的主要学科,负责为患者实施以系统抗肿瘤治疗为主的转化及围手术期治疗,并负责治疗期间的随访、评估等。
(4)感染科或肝病科:负责治疗全程中基础肝病(肝炎、肝硬化)及相关并发症的评估和管理,对转化及围手术期治疗的具体方案及手术耐受性提出建议,以及转化成功术后患者的长期随访及管理。
(5)影像科(含超声):负责患者的影像学诊断及疗效评价,协助主管医师准确评估治疗前、治疗过程中及治疗后的肿瘤情况(肿瘤大小、活性范围、病灶数目、肿瘤与脉管关系、术前3D规划等),为患者选择及手术时机、手术方式的选择提供重要参考意见。
(6)病理科(含分子检测):负责患者的组织学诊断和疗效评价,以及协助对部分不良反应的原因及程度进行判断(如免疫性肝炎等),并协助探索可用于转化及围手术期治疗疗效预测及适宜人群筛选的分子指标。
(7)其他学科:除以上常规参与MDT的学科外,在肝癌转化及围手术期治疗过程中可能还需其他多个学科的参与,如麻醉科、ICU协助围手术期评估及管理,心内科、呼吸内科、内分泌科、消化内科、皮肤科等协助并发症及不良反应的处理,中医科、营养科协助调理患者全身情况,护理团队协助指导患者的日常护理及随访等。
总之,MDT合作贯穿肝癌转化及围手术期治疗全程。在治疗不同阶段,主导或具体负责的学科会发生变化,需多个学科的医务人员根据患者的病情发展及时沟通和协调,实现以患者为中心的个体化全程管理,为更多肝癌患者赢得高质量的长期无瘤生存。
共识18:肝癌转化及围手术期治疗全程提倡MDT合作,需多学科的医务人员根据患者病情发展及时沟通和协作,实现以患者为中心的个体化全程管理,为更多肝癌患者赢得高质量的长期无瘤生存(证据等级2,推荐A)。
十三、总结
尽管肝癌早期筛查在肝癌的早期诊断中发挥重要作用,但我国仍有64%的肝癌患者在初诊时已为中晚期,失去手术切除机会,从而影响长期生存。外科技术的进步(如ALPPS、PVE)、系统抗肿瘤治疗新模式的涌现(如抗血管生成联合免疫治疗等)以及传统局部治疗的升级(HAIC联合TACE)等可以显著提高ORR,这为无法手术切除肝癌患者转化治疗带来重要契机,使部分中晚期肝癌患者获得长期生存机会。但如何合理选择这些手段、如何把握转化治疗后手术时机、如何合理选择合适人群等方面,是当前肝癌转化治疗领域的重要课题。尚需通过更多临床实践和相关机制研究探索进一步改善中晚期肝癌患者预后的理想治疗模式。
影响肝癌患者长期生存的另一个重要因素是术后高复发转移率。已有证据显示,以免疫治疗为代表,单药或联合治疗可作为新辅助或术后辅助治疗手段,降低肿瘤的生物学行为和术后复发转移风险。采取免疫治疗联合靶向药物、免疫治疗单药或其他联合治疗策略用于具有高危复发转移风险的肝癌新辅助或术后辅助治疗,有望进一步提高伴高危复发转移因素肝癌患者的疗效。目前已有多项相关Ⅲ期临床研究正在进行中,结果值得期待。
综上所述,靶免时代的到来以及新技术和新手段的不断革新为肝癌治疗带来了新曙光。但是,未来仍需开展更多的临床和相关基础研究,不断探索更有效、安全、可及的肝癌转化及围手术期治疗模式,从而改善患者的长期生存。
中国抗癌协会肝癌专业委员会转化治疗协作组. 原发性肝癌转化及围手术期治疗中国专家共识(2024版)[J]. 中华消化外科杂志, 2024, 23(4): 492-513. DOI: 10.3760/cma.j.cn115610-20240228-00135.http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cn115610-20240228-24135
-
表 1 中晚期肝癌与系统治疗相关的转化报道概览
Table 1 Reports on conversion therapy related to systemic therapy in advanced liver cancer
系统抗肿瘤治疗方案 发表年份 样本量(例) 转化成功病例的中国肝癌分期/BCLC分期 治疗周期 客观缓解率 转化率c 单药TKIs 仑伐替尼[18] 2023 5 3例B期/2例C期 3(2~8)个月 3/5a MPR 仑伐替尼[19] 2022 9 2例B期/6例C期 8(4~50)周 2/9a 88% TKIs+免疫检查点抑制剂 信迪利单克隆抗体+仑伐替尼[20] 2023 36 8例B期/4例C期 4.4个月 66.7%a36.1%b 33% 替雷利珠单克隆抗体+仑伐替尼[21] 2023 24 - 4个周期 75.0%a54.2%b 70.8%(3例pCR) PD‑1单克隆抗体+仑伐替尼[22] 2022 107 1例Ⅰa期/3例Ⅰb期/6例Ⅱb期/17例Ⅲa期/3例Ⅲb期 90.5 d 50%b 28%(10例pCR) PD‑1单克隆抗体+仑伐替尼[23] 2023 56 2例B期/29例C期 - 53.6%a44.6%b 55.4% TKIs+PD‑1单克隆抗体[24] 2023 101 3例Ⅰb期/1例Ⅱa期/5例Ⅱb期/11例Ⅱa期/4例Ⅲb期 3.9个月 49.5%a32.7%b 23.8% TKIs+PD‑1单克隆抗体[25] 2022 187 9例Ⅱb期/10例Ⅲa期/10例Ⅲb期 - 37.4%a 15.5% 替雷利珠单克隆抗体+TKIs[26] 2022 44 - - 47.7%b 34.1%(3例pCR) PD‑1单克隆抗体+TKIs[27] 2021 63 1例Ⅰb期/1例Ⅱa期/1例Ⅱb期/7例Ⅲa期 3.2(2.4~8.3)个月 - 15.9%(6例pCR) 纳武利尤单克隆抗体+卡博替尼[28] 2020 1 - 8周 - pCR PD‑1单克隆抗体+仑伐替尼[29] 2020 33 - - 45.5%a 42.4% 大分子抗血管生成+免疫检查点抑制剂 阿替利珠单克隆抗体+贝伐珠单克隆抗体[30] 2023 156 - - 32%b 10.9% 阿替利珠单克隆抗体+贝伐珠单克隆抗体[31] 2023 1 - 15个疗程 - MPR 信迪利单克隆抗体+贝伐珠单克隆抗体类似物[32] 2022 30 13例B期 4.1(2.0~5.7)个月 23.3%b 43.3% 阿替利珠单克隆抗体+贝伐珠单克隆抗体[33] 2022 1 1例C期 7个周期 - pCR 阿替利珠单克隆抗体+贝伐珠单克隆抗体[34] 2021 32 - - - 19% 注: TKIs为酪氨酸激酶抑制剂;PD‑1为程序性死亡[蛋白]‑1;“-”为不能溯源;a基于改良实体瘤疗效评价标准评估;b基于实体瘤疗效评价标准v1.1评估;c除根治性切除外,部分病例还包括根治性射频或根治性经动脉化疗栓塞;MPR为>50%的病理学缓解;pCR为病理学完全缓解;BCLC为巴塞罗那临床肝癌(临床)问题 步骤1 步骤2 步骤3 步骤4 步骤5 (证据等级1a) (证据等级2a) (证据等级3a) (证据等级4a) (证据等级5a) 这个疾病有多普遍?(患病率) 当地的,当前的随机样本调查(或普查) 与当地情况相匹配调查的系统综述b 当地的,非随机样本调查b 病例系列b N/A 诊断或监测实验是否准确?(诊断) 一致地应用了参考标准和盲法的横断面研究的系统综述 一致地应用了参考标准和盲法的横断面研究 非连续病例研究,或研究未能一致地应用参考标准b 病例对照研究,或应用了差的或非独立的参考标准b 基于机制的推理 若不给予这个治疗会发生什么?(预后) 起始队列研究的系统综述 起始队列研究 队列研究或随机研究的对照组a 病例系列或病例对照研究,或低质量预后队列研究b N/A 这个治疗有用吗?(治疗效益) 随机试验或单病例随机对照试验的系统综述 随机试验或具有巨大效果的观察性研究 非随机对照队列/随访研究b 病例系列,病例对照研究,或历史对照研究b 基于机制的推理 这个治疗常见的伤害是什么?(治疗伤害) 随机试验的系统综述,巢式病例对照研究的系统综述,针对你所提临床问题患者的n⁃of⁃1试验,具有巨大效果的观察性研究 单个随机试验或(特殊地)具有巨大效果的观察性研究 非随机对照队列/随访研究(上市后监测)提供,足够数量来排除常见的伤害(对长期伤害需要足够长的随访时间)b 病例系列,病例对照研究,或历史对照研究b 基于机制的推理 这个治疗少见的伤害是什么?(治疗伤害) 随机试验或n⁃of⁃1试验的系统综述 随机试验或(特殊地)具有巨大效果的观察性研究 这个试验(早期发现)值得吗?(筛查) 随机研究的系统综述 随机试验 非随机对照队列/随访研究a 病例系列,病例对照研究,或历史对照研究b 基于机制的推理 注: a根据研究质量、精确度、间接性,各个研究间不一致,若绝对效应值小,证据等级会被调低;若效应值很大,等级会被上调;b系统综述普遍地优于单项研究;N/A为此项无推荐强度 定义描述 强推荐 非常确信真实值接近效应估计值。基于:高质量研究证据支持净获益(例如,利大于弊);研究结果一致性好,没有或很少有例外;对研究质量轻微或没有疑虑;和(或)获得专家组成员的同意。其他基于高质量证据,确信利明显大于弊(包括指南的文献回顾和分析中讨论的内容)也可支持强推荐。 中等程度推荐 对效应估计值有中等程度信心。基于:较好研究证据支持净获益(例如,利大于弊);研究结果一致,有轻微和/或少数例外;对研究质量轻微或少量疑虑;和(或)获得专家组成员的同意。其他基于中等质量证据且利大于弊(包括指南的文献回顾和分析中讨论的内容)也可形成中等程度推荐。 弱推荐 对效应估计值信心有限,该推荐为临床实践提供了目前最好的指导。基于:有限的研究证据支持净获益(例如,利大于弊);研究结果一致,但有重要的例外;研究质量有重要的疑虑;和(或)获得专家组成员的同意。其他基于有限的证据(包括指南的文献回顾和分析中讨论的内容)也可形成弱推荐。 -
[1] 肝癌术后辅助治疗中国专家共识协作组,中国医师协会外科医师分会,中国抗癌协会肝癌专业委员会,等.肝癌术后辅助治疗中国专家共识(2023版)[J].中华消化外科杂志,2023,22(4):437‑448. DOI:10.3760/cma.j.cn115610-2023 0315-00108. [2] 中华人民共和国国家卫生健康委员会医政医管局.原发性肝癌诊疗指南(2022年版)[J].中华消化外科杂志,2022,21(2):143-168. DOI: 10.3760/cma.j.cn115610-20220124-00053. [3] 夏永祥,张峰,李相成,等.原发性肝癌10 966例外科治疗分析[J].中华外科杂志,2021,59(1):6‑17. DOI: 10.3760/cma.j.cn112139-20201110-00791. [4] ParkJW, ChenM, ColomboM, et al. Global patterns of hepatocellular carcinoma management from diagnosis to death: the BRIDGE Study[J]. Liver Int,2015,35(9):2155-2166. DOI: 10.1111/liv.12818.
[5] ChengAL, QinS, IkedaM, et al. Updated efficacy and safety data from IMbrave150: atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma[J]. J Hepatol,2022,76(4):862‑873. DOI:10.1016/j.jhep.2021. 11.030.
[6] 杨世忠,冯晓彬,董家鸿.精准外科理念指导下的肝癌外科治疗[J].精准医学杂志,2018,33(3):189-192,196. DOI:10. 13362/j.jpmed.201803001. [7] AloiaTA. Associating liver partition and portal vein ligation for staged hepatectomy: portal vein embolization should remain the gold standard[J]. JAMA Surg,2015,150(10):927-928. DOI: 10.1001/jamasurg.2015.1646.
[8] PironL, DeshayesE, EscalL, et al. Portal vein embolization: present and future[J]. Bull Cancer,2017,104(5):407‑416. DOI: 10.1016/j.bulcan.2017.03.009.
[9] DupréA, HitierM, PeyratP, et al. Associating portal embolization and artery ligation to induce rapid liver regeneration in staged hepatectomy[J]. Br J Surg,2015,102(12):1541‑1550. DOI: 10.1002/bjs.9900.
[10] GlantzounisGK, TokidisE, BasourakosSP, et al. The role of portal vein embolization in the surgical management of primary hepatobiliary cancers. A systematic review[J]. Eur J Surg Oncol,2017,43(1):32‑41. DOI:10.1016/j.ejso.2016. 05.026.
[11] SchnitzbauerAA, LangSA, GoessmannH, et al. Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2‑staged extended right hepatic resection in small‑for‑size settings[J]. Ann Surg,2012,255(3):405‑414. DOI:10.1097/SLA.0b0 13e31824856f5.
[12] WangZ, PengY, HuJ, et al. Associating liver partition and portal vein ligation for staged hepatectomy for unresectable hepatitis B Virus‑related hepatocellular carcinoma: a single center study of 45 patients[J]. Ann Surg,2020,271(3):534‑541. DOI: 10.1097/SLA.0000000000002942.
[13] PengY, WangZ, QuX, et al. Transcatheter arterial embo-lization‑salvaged ALPPS, a novel ALPPS procedure especially for patients with hepatocellular carcinoma and severe fibrosis/cirrhosis[J]. Hepatobiliary Surg Nutr,2022,11(4):504‑514. DOI: 10.21037/hbsn-21-466.
[14] LiPP, HuangG, JiaNY, et al. Associating liver partition and portal vein ligation for staged hepatectomy versus sequ-ential transarterial chemoembolization and portal vein embolization in staged hepatectomy for HBV‑related hepa-tocellular carcinoma: a randomized comparative study[J]. Hepatobiliary Surg Nutr,2022,11(1):38‑51. DOI: 10.21037/hbsn-20-264.
[15] RenZ, XuJ, BaiY, et al. Sintilimab plus a bevacizumab bio-similar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT‑32): a randomised, open-label, phase 2‑3 study[J]. Lancet Oncol,2021,22(7):977‑990. DOI: 10.1016/S1470-2045(21)00252-7.
[16] QinS, ChanSL, GuS, et al. Camrelizumab plus rivoceranib versus sorafenib as first‑line therapy for unresectable hepa-tocellular carcinoma (CARES‑310): a randomised, open-label, international phase 3 study[J]. Lancet,2023,402(10408):1133‑1146. DOI: 10.1016/S0140-6736(23)00961-3.
[17] FinnRS, QinS, IkedaM, et al. Atezolizumab plus bevacizu-mab in unresectable hepatocellular carcinoma[J]. N Engl J Med,2020,382(20):1894‑1905. DOI:10.1056/NEJMoa191 5745.
[18] ShiozakiH, FurukawaK, HarukiK, et al. A multidiscipli-nary treatment strategy with conversion surgery for hepa-tocellular carcinoma[J]. Anticancer Res,2023,43(4):1761-1766. DOI: 10.21873/anticanres.16329.
[19] HidakaM, HaraT, SoyamaA, et al. The outcome of conversion liver resection surgery by lenvatinib treatment: a single center experience[J]. Anticancer Res,2022,42(6):3049-3054. DOI: 10.21873/anticanres.15791.
[20] WangL, WangH, CuiY, et al. Sintilimab plus lenvatinib con-version therapy for intermediate/locally advanced hepatocellular carcinoma: a phase 2 study[J]. Front Oncol,2023,13:1115109. DOI: 10.3389/fonc.2023.1115109.
[21] SongT. A prospective, single‑arm, phase Ⅱ clinical study of tislelizumab in combination with lenvatinib for perioperative treatment of resectable primary hepatocellular carcinoma with high risk of recurrence[J]. J Clin Oncol,2023,41(16_suppl):e16218. DOI: 10.1200/JCO.2023.41.16_suppl.e16218.
[22] YiY, SunBY, WengJL, et al. Lenvatinib plus anti‑PD‑1 therapy represents a feasible conversion resection strategy for pati-ents with initially unresectable hepatocellular carcinoma: a retrospective study[J]. Front Oncol,2022,12:1046584. DOI: 10.3389/fonc.2022.1046584.
[23] ZhangW, TongS, HuB, et al. Lenvatinib plus anti‑PD‑1 antibodies as conversion therapy for patients with unresectable intermediate‑advanced hepatocellular carcinoma: a single‑arm, phase Ⅱ trial[J]. J Immunother Cancer,2023,11(9):e007366. DOI: 10.1136/jitc-2023-007366.
[24] ZhuXD, HuangC, ShenYH, et al. Hepatectomy after conver-sion therapy using tyrosine kinase inhibitors plus anti-PD-1 antibody therapy for patients with unresectable hepatocellular carcinoma[J]. Ann Surg Oncol,2023,30(5):2782-2790. DOI: 10.1245/s10434-022-12530-z.
[25] XuB, ZhuXD, ShenYH, et al. Criteria for identifying potentially resectable patients with initially oncologically unresectable hepatocellular carcinoma before treatment with lenvatinib plus an anti‑PD‑1 antibody[J]. Front Immunol,2022,13:1016736. DOI: 10.3389/fimmu.2022.1016736.
[26] WangL, ZhaoY, ZhangT, et al. 141P Efficacy and safety of tislelizumab combined with targeted therapy as first‑line treatment for unresectable hepatocellular carcinoma: a real‑world study[J]. Immuno Oncol Tech,2022,16(1_suppl):100253. DOI: 10.1016/j.iotech.2022.100253.
[27] ZhuXD, HuangC, ShenYH, et al. Downstaging and resection of initially unresectable hepatocellular carcinoma with tyrosine kinase inhibitor and anti‑PD‑1 antibody combinations[J]. Liver Cancer,2021,10(4):320‑329. DOI:10.11 59/000514313.
[28] HoWJ, SharmaG, ZhuQ, et al. Integrated immunological analysis of a successful conversion of locally advanced hepatocellular carcinoma to resectability with neoadjuvant therapy[J]. J Immunother Cancer,2020,8(2):e000932. DOI: 10.1136/jitc-2020-000932.
[29] 张雯雯,胡丙洋,韩骏,等.PD‑1抑制剂与多靶点酪氨酸激酶抑制剂联合方案用于进展期肝癌转化治疗研究的初步报告[J].中华肝胆外科杂志,2020,26(12):947‑948. DOI:10.37 60/cma.j.cn113884-20201203-00611. [30] ShimoseS, IwamotoH, ShironoT, et al. The impact of cura-tive conversion therapy aimed at a cancer‑free state in patients with hepatocellular carcinoma treated with atezo-lizumab plus bevacizumab[J]. Cancer Med,2023,12(11):12325‑12335. DOI: 10.1002/cam4.5931.
[31] MiyataT, SugiK, HorinoT, et al. Conversion surgery after atezolizumab plus bevacizumab for primary and peritoneal metastasis after hepatocellular carcinoma rupture[J]. Anticancer Res,2023,43(2):943‑947. DOI:10.21873/anti canres.16239.
[32] SunH, ZhuX, GaoQ, et al. 711P Sintilimab combined with bevacizumab biosimilar as a conversion therapy in potentially resectable intermediate stage hepatocellular carcinoma (HCC): a phase Ⅱ trial[J]. Ann Oncol,2022,33:S867-S868. DOI: 10.1016/j.annonc.2022.07.835.
[33] FukunagaA, TakataK, ItohS, et al. Complete tumor necrosis confirmed by conversion hepatectomy after atezolizumab-bevacizumab treatment for advanced‑stage hepatocellular carcinoma with lung metastasis[J]. Clin J Gastroenterol,2023,16(2):224‑228. DOI: 10.1007/s12328-022-01744-z.
[34] KudoM. A novel treatment strategy for patients with inter-mediate‑stage HCC who are not suitable for TACE: upfront systemic therapy followed by curative conversion[J]. Liver Cancer,2021,10(6):539‑544. DOI: 10.1159/000519749.
[35] 中国医师协会介入医师分会临床诊疗指南专委会.中国肝细胞癌经动脉化疗栓塞(TACE)治疗临床实践指南(2023年版)[J].中华医学杂志,2023,103(34):2674‑2694.DOI:10.37 60/cma.j.cn112137-20230630-01114. [36] 中国抗癌协会肿瘤介入学专业委员会.药物洗脱微球治疗不可切除原发性肝癌的临床应用共识[J].中华放射学杂志,2022,56(4):349‑355. DOI:10.3760/cma.j.cn112149-2021 0526-00511. [37] ZhangZF, LuoYJ, LuQ, et al. Conversion therapy and suitable timing for subsequent salvage surgery for initially unresectable hepatocellular carcinoma: What is new?[J]. World J Clin Cases,2018,6(9):259‑273. DOI: 10.12998/wjcc.v6.i9.259.
[38] ZhangY, HuangG, WangY, et al. Is salvage liver resection necessary for initially unresectable hepatocellular carcinoma patients downstaged by transarterial chemoembolization? Ten years of experience[J]. Oncologist,2016,21(12):1442‑1449. DOI: 10.1634/theoncologist.2016-0094.
[39] AllardMA, SebaghM, RuizA, et al. Does pathological res-ponse after transarterial chemoembolization for hepatocellular carcinoma in cirrhotic patients with cirrhosis predict outcome after liver resection or transplantation?[J]. J Hepatol,2015,63(1):83‑92. DOI: 10.1016/j.jhep.2015.01.023.
[40] ChenS, PengZ, ZhangY, et al. Lack of response to transarterial chemoembolization for intermediate‑stage hepatocellular carcinoma: abandon or repeat?[J]. Radiology,2021,298(3):680‑692. DOI: 10.1148/radiol.2021202289.
[41] LyuN, WangX, LiJB, et al. Arterial chemotherapy of oxaliplatin plus fluorouracil versus sorafenib in advanced hepa-tocellular carcinoma: a biomolecular exploratory, rando-mized, phase Ⅲ trial (FOHAIC‑1)[J]. J Clin Oncol,2022,40(5):468‑480. DOI: 10.1200/JCO.21.01963.
[42] LiB, QiuJ, ZhengY, et al. Conversion to resectability using transarterial chemoembolization combined with hepatic arterial infusion chemotherapy for initially unresectable hepatocellular carcinoma[J]. Ann Surg Open,2021,2(2):e057. DOI: 10.1097/AS9.0000000000000057.
[43] HeC, GeN, WangX, et al. Conversion therapy of large un-resectable hepatocellular carcinoma with ipsilateral portal vein tumor thrombus using portal vein embolization plus transcatheter arterial chemoembolization[J]. Front Oncol,2022,12:923566. DOI: 10.3389/fonc.2022.923566.
[44] ZhuHD, LiHL, HuangMS, et al. Transarterial chemoembolization with PD‑(L)1 inhibitors plus molecular targeted therapies for hepatocellular carcinoma (CHANCE001)[J]. Signal Transduct Target Ther,2023,8(1):58. DOI: 10.1038/s41392-022-01235-0.
[45] PengZ, FanW, ZhuB, et al. Lenvatinib combined with trans-arterial chemoembolization as first‑line treatment for advan-ced hepatocellular carcinoma: a phase Ⅲ, randomized clini-cal trial (LAUNCH)[J]. J Clin Oncol,2023,41(1):117‑127. DOI: 10.1200/JCO.22.00392.
[46] WuJY, WuJY, LiYN, et al. Lenvatinib combined with anti-PD‑1 antibodies plus transcatheter arterial chemoembolization for neoadjuvant treatment of resectable hepatocellular carcinoma with high risk of recurrence: a multicenter retrospective study[J]. Front Oncol,2022,12:985380. DOI: 10.3389/fonc.2022.985380.
[47] CaoY, ZhangX, YueY, et al. Donafenib combined with camrelizumab and transarterial chemoembolization (TACE) as conversion therapy for unresectable hepatocellular carcinoma (uHCC): a prospective, single‑arm, phase Ⅱ study[J]. J Clin Oncol,2023,41(16_suppl):e16203. DOI:10.1200/JCO. 2023.41.16_suppl.e16203.
[48] LiQJ, HeMK, ChenHW, et al. Hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin versus transarterial chemoembolization for large hepatocellular carcinoma: a randomized phase Ⅲ trial[J]. J Clin Oncol,2022,40(2):150‑160. DOI: 10.1200/JCO.21.00608.
[49] HeM, LiQ, ZouR, et al. Sorafenib plus hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin vs sora-fenib alone for hepatocellular carcinoma with portal vein invasion: a randomized clinical trial[J]. JAMA Oncol,2019, 5(7):953‑960. DOI: 10.1001/jamaoncol.2019.0250.
[50] ZhengK, ZhuX, FuS, et al. Sorafenib plus hepatic arterial infusion chemotherapy versus sorafenib for hepatocellular carcinoma with major portal vein tumor thrombosis: a randomized trial[J]. Radiology,2022,303(2):455‑464. DOI: 10.1148/radiol.211545.
[51] HeMK, LiangRB, ZhaoY, et al. Lenvatinib, toripalimab, plus hepatic arterial infusion chemotherapy versus lenvatinib alone for advanced hepatocellular carcinoma[J]. Ther Adv Med Oncol,2021,13:17588359211002720. DOI: 10.1177/17588359211002720.
[52] ZhangTQ, GengZJ, ZuoMX, et al. Camrelizumab (a PD‑1 inhibitor) plus apatinib (an VEGFR‑2 inhibitor) and hepa-tic artery infusion chemotherapy for hepatocellular carcinoma in Barcelona Clinic Liver Cancer stage C (TRIPLET): a phase Ⅱ study[J]. Signal Transduct Target Ther,2023,8(1):413. DOI: 10.1038/s41392-023-01663-6.
[53] LiuD, MuH, LiuC, et al. Hepatic artery infusion chemotherapy (HAIC) combined with sintilimab and bevacizu-mab biosimilar (IBI305) for initial unresectable hepatoce-llular carcinoma (HCC): a prospective, single‑arm phase Ⅱ trial[J]. J Clin Oncol,2022,40(16_suppl):4073. DOI: 10.1200/JCO.2022.40.16_suppl.4073.
[54] DongW, ZhangS, HuoZ, et al. Lenvatinib in combination with PD‑1 inhibitor and hepatic arterial infusion chemotherapy (HAIC) for patients with potentially resectable hepa-tocellular carcinoma: a retrospective analysis[J]. J Clin Oncol,2023,41(16_suppl):e16160. DOI:10.1200/JCO.2023.41. 16_suppl.e16160.
[55] TanK, HeX, ZhangH, et al. Efficacy and safety of tislelizumab combined with lenvatinib and FOLFOX4‑HAIC in conversion therapy of middle‑advanced stage hepatocellular carcinoma (HCC): a real‑world retrospective study[J]. J Clin Oncol,2023,41(16_suppl):e16137. DOI:10.1200/JCO. 2023.41.16_suppl.e16137.
[56] ZhangW, GaoW, LiuC, et al. 999P Donafenib combined with hepatic artery infusion chemotherapy (HAIC) and sintilimab for unresectable hepatocellular carcinoma (uHCC): a prospective, single‑arm phase Ⅱ trial (DoHAICs study)[J]. Ann Oncol,2023,34:S613. DOI:10.1016/j.annonc.2023. 09.2143.
[57] LeeIJ, KimJW, HanKH, et al. Concurrent chemoradiotherapy shows long‑term survival after conversion from locally advanced to resectable hepatocellular carcinoma[J]. Yonsei Med J,2014,55(6):1489‑1497. DOI:10.3349/ymj.2014.55. 6.1489.
[58] LeeHS, ChoiGH, ChoiJS, et al. Surgical resection after down‑staging of locally advanced hepatocellular carcinoma by localized concurrent chemoradiotherapy[J]. Ann Surg Oncol,2014,21(11):3646‑3653. DOI: 10.1245/s10434-014-3652-3.
[59] ByunHK, KimHJ, ImYR, et al. Dose escalation by intensity modulated radiotherapy in liver‑directed concurrent chemoradiotherapy for locally advanced BCLC stage C hepatocellular carcinoma[J]. Radiother Oncol,2019,133:1‑8. DOI: 10.1016/j.radonc.2018.12.025.
[60] ChiangCL, ChiuK, ChanK, et al. Sequential transarterial chemoembolisation and stereotactic body radiotherapy followed by immunotherapy as conversion therapy for patients with locally advanced, unresectable hepatocellular carcinoma (START‑FIT): a single‑arm, phase 2 trial[J]. Lancet Gastroenterol Hepatol,2023,8(2):169‑178. DOI:10. 1016/S2468-1253(22)00339-9.
[61] WangQ, JiX, SunJ, et al. Comparison of stereotactic body radiotherapy with and without lenvatinib for advanced hepatocellular carcinoma: a propensity score analysis[J]. J Cancer Res Clin Oncol,2023,149(10):7441‑7452. DOI:10. 1007/s00432-023-04652-y.
[62] FanJ, TangZY, YuYQ, et al. Improved survival with resection after transcatheter arterial chemoembolization (TACE) for unresectable hepatocellular carcinoma[J]. Dig Surg,1998,15(6):674‑678. DOI: 10.1159/000018676.
[63] KulikLM, AtassiB, van HolsbeeckL, et al. Yttrium‑90 micro-spheres (TheraSphere) treatment of unresectable hepatocellular carcinoma: downstaging to resection, RFA and bridge to transplantation[J]. J Surg Oncol,2006,94(7):572-586. DOI: 10.1002/jso.20609.
[64] LewandowskiRJ, KulikLM, RiazA, et al. A comparative analysis of transarterial downstaging for hepatocellular carcinoma: chemoembolization versus radioembolization[J]. Am J Transplant,2009,9(8):1920‑1928. DOI: 10.1111/j.1600-6143.2009.02695.x.
[65] ShindohJ, KawamuraY, KobayashiY, et al. Prognostic impact of surgical intervention after lenvatinib treatment for advan-ced hepatocellular carcinoma[J]. Ann Surg Oncol,2021,28(12):7663‑7672. DOI: 10.1245/s10434-021-09974-0.
[66] KanekoS, TsuchiyaK, YasuiY, et al. Conversion surgery for hepatocellular carcinoma after tyrosine kinase inhibitor treatment[J]. JGH Open,2022,6(5):301‑308. DOI:10.10 02/jgh3.12735.
[67] YarchoanM, ZhuQ, DurhamJN, et al. Feasibility and efficacy of neoadjuvant cabozantinib and nivolumab in pati-ents with borderline resectable or locally advanced hepatocellular carcinoma (HCC)[J]. J Clin Oncol,2021,39(3_suppl):335. DOI: 10.1200/JCO.2021.39.3_suppl.335.
[68] KasebAO, Tran CaoHS, MohamedYI, et al. Final results of a randomized, open label, perioperative phase Ⅱ study evaluating nivolumab alone or nivolumab plus ipilimu-mab in patients with resectable HCC[J]. J Clin Oncol,2020,38(15_suppl):4599. DOI:10.1200/JCO.2020.38.15_suppl. 4599.
[69] FinnRS, KudoM, MerleP, et al. LBA34 Primary results from the phase Ⅲ LEAP‑002 study: lenvatinib plus pembrolizumab versus lenvatinib as first‑line (1L) therapy for advan-ced hepatocellular carcinoma (aHCC)[J]. Ann Oncol,2022,33:S1401. DOI: 10.1016/j.annonc.2022.08.031.
[70] DhirM, SassonAR. Surgical management of liver metastases from colorectal cancer[J]. J Oncol Pract,2016,12(1):33‑39. DOI: 10.1200/JOP.2015.009407.
[71] CaoY, TangH, HuB, et al. Comparison of survival benefit between salvage surgery after conversion therapy versus surgery alone for hepatocellular carcinoma with portal vein tumor thrombosis: a propensity score analysis[J]. HPB (Oxford),2023,25(7):775‑787. DOI:10.1016/j.hpb.2023. 03.004.
[72] BertaccoA, VitaleA, MescoliC, et al. Sorafenib treatment has the potential to downstage advanced hepatocellular carcinoma before liver resection[J]. Per Med,2020,17(2):83‑87. DOI: 10.2217/pme-2018-0114.
[73] KimTS, KimJH, KimBH, et al. Complete response of advan-ced hepatocellular carcinoma to sorafenib: another case and a comprehensive review[J]. Clin Mol Hepatol,2017,23(4):340‑346. DOI: 10.3350/cmh.2016.0070.
[74] IrtanS, Chopin‑LalyX, RonotM, et al. Complete regression of locally advanced hepatocellular carcinoma induced by sorafenib allowing curative resection[J]. Liver Int,2011,31(5):740‑743. DOI: 10.1111/j.1478-3231.2010.02441.x.
[75] ClearyJM, TanabeKT, LauwersGY, et al. Hepatic toxicities associated with the use of preoperative systemic therapy in patients with metastatic colorectal adenocarcinoma to the liver[J]. Oncologist,2009,14(11):1095‑1105. DOI:10. 1634/theoncologist.2009-0152.
[76] KasebAO, VenceL, BlandoJ, et al. Immunologic correlates of pathologic complete response to preoperative immunotherapy in hepatocellular carcinoma[J]. Cancer Immunol Res,2019,7(9):1390‑1395. DOI: 10.1158/2326-6066.CIR-18-0605.
[77] KasebAO, Carmagnani PestanaR, VenceLM, et al. Rando-mized, open‑label, perioperative phase Ⅱ study evaluating nivolumab alone versus nivolumab plus ipilimumab in patients with resectable HCC[J]. J Clin Oncol,2019,37(4_ suppl):185. DOI: 10.1200/JCO.2019.37.4_suppl.185.
[78] ShenYH, HuangC, ZhuXD, et al. The safety profile of hepatectomy following preoperative systemic therapy with lenvatinib plus anti‑PD‑1 antibodies versus hepatectomy alone in patients with hepatocellular carcinoma[J]. Ann Surg Open,2022,3(2):e163. DOI:10.1097/AS9.00000000 00000163.
[79] LuoL, HeY, ZhuG, et al. Hepatectomy after conversion therapy for initially unresectable HCC: what is the difference?[J]. J Hepatocell Carcinoma,2022,9:1353‑1368. DOI: 10.2147/JHC.S388965.
[80] PayeF, JagotP, VilgrainV, et al. Preoperative chemoembolization of hepatocellular carcinoma: a comparative study[J]. Arch Surg,1998,133(7):767‑772. DOI:10.1001/arch surg.133.7.767.
[81] LiC, WangMD, LuL, et al. Preoperative transcatheter arterial chemoembolization for surgical resection of huge hepa-tocellular carcinoma (≥ 10 cm): a multicenter propensity matching analysis[J]. Hepatol Int,2019,13(6):736‑747. DOI: 10.1007/s12072-019-09981-0.
[82] MajnoPE, AdamR, BismuthH, et al. Influence of preoperative transarterial lipiodol chemoembolization on resection and transplantation for hepatocellular carcinoma in patients with cirrhosis[J]. Ann Surg,1997,226(6):688-703. DOI: 10.1097/00000658-199712000-00006.
[83] TustumiF, ErnaniL, CoelhoFF, et al. Preoperative strategies to improve resectability for hepatocellular carcinoma: a systematic review and meta‑analysis[J]. HPB (Oxford),2018,20(12):1109‑1118. DOI: 10.1016/j.hpb.2018.06.1798.
[84] LiN, FengS, XueJ, et al. Hepatocellular carcinoma with main portal vein tumor thrombus: a comparative study comparing hepatectomy with or without neoadjuvant radio-therapy[J]. HPB (Oxford),2016,18(6):549‑556. DOI:10.10 16/j.hpb.2016.04.003.
[85] ZhouH, SongT. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma[J]. Biosci Trends,2021,15(3):155‑160. DOI: 10.5582/bst.2021.01091.
[86] DucreuxM, Abou‑AlfaGK, Bekaii‑SaabT, et al. The mana-gement of hepatocellular carcinoma. Current expert opinion and recommendations derived from the 24th ESMO/World Congress on Gastrointestinal Cancer, Barcelona,2022[J]. ESMO Open,2023,8(3):101567. DOI:10.1016/j.esmoop. 2023.101567.
[87] YooC, KimJH, RyuMH, et al. Clinical outcomes with multikinase inhibitors after progression on first‑line atezolizu-mab plus bevacizumab in patients with advanced hepatocellular carcinoma: a multinational multicenter retrospective study[J]. Liver Cancer,2021,10(2):107‑114. DOI:10.11 59/000512781.
[88] WongJ, KwokG, TangV, et al. Ipilimumab and nivolumab/pembrolizumab in advanced hepatocellular carcinoma refractory to prior immune checkpoint inhibitors[J]. J Immunother Cancer,2021,9(2):e001945. DOI: 10.1136/jitc-2020-001945.
[89] BruixJ, QinS, MerleP, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double‑blind, placebo-controlled, phase 3 trial[J]. Lancet,2017,389(10064):56-66. DOI: 10.1016/S0140-6736(16)32453-9.
[90] LimHY, KimYJ, HuangYH, et al. 1009P Regorafenib in pati-ents (pts) with unresectable hepatocellular carcinoma (uHCC) in real‑world practice in Asia: interim results from the observational REFINE study[J]. Ann Oncol,2020,31:S699. DOI: 10.1016/j.annonc.2020.08.1125.
[91] QinS, LiQ, GuS, et al. Apatinib as second‑line or later therapy in patients with advanced hepatocellular carcinoma (AHELP): a multicentre, double‑blind, randomised, placebo‑controlled, phase 3 trial[J]. Lancet Gastroenterol Hepatol,2021,6(7):559‑568. DOI: 10.1016/S2468-1253(21)00109-6.
[92] QinS, RenZ, MengZ, et al. Camrelizumab in patients with previously treated advanced hepatocellular carcinoma: a multicentre, open‑label, parallel‑group, randomised, phase 2 trial[J]. Lancet Oncol,2020,21(4):571‑580. DOI:10.10 16/S1470-2045(20)30011-5.
[93] EdelineJ, MerleP, FangW, et al. Clinical outcomes associa-ted with tislelizumab in patients (pts) with advanced hepa-tocellular carcinoma (HCC) who have been previously treated with sorafenib (SOR) or lenvatinib (LEN) in RATIONALE-208[J]. J Clin Oncol,2022,40(4_suppl):420. DOI: 10.1200/JCO.2022.40.4_suppl.420.
[94] QinS, ChenZ, FangW, et al. Pembrolizumab versus placebo as second‑line therapy in patients from asia with advanced hepatocellular carcinoma: a randomized, double-blind, phase Ⅲ trial[J]. J Clin Oncol,2023,41(7):1434-1443. DOI: 10.1200/JCO.22.00620.
[95] LiS, ZhongC, LiQ, et al. Neoadjuvant transarterial infusion chemotherapy with FOLFOX could improve outcomes of resectable BCLC stage A/B hepatocellular carcinoma patients beyond Milan criteria: an interim analysis of a multi‑center, phase 3, randomized, controlled clinical trial[J]. J Clin Oncol,2021,39(15_suppl):4008. DOI:10.1200/JCO. 2021.39.15_suppl.4008.
[96] WeiX, JiangY, ZhangX, et al. Neoadjuvant three-dimensional conformal radiotherapy for resectable hepatocellular carcinoma with portal vein tumor thrombus: a rando-mized, open‑label, multicenter controlled study[J]. J Clin Oncol,2019,37(24):2141‑2151. DOI: 10.1200/JCO.18.02184.
[97] KamiyamaT, NakanishiK, YokooH, et al. Efficacy of preoperative radiotherapy to portal vein tumor thrombus in the main trunk or first branch in patients with hepatocellular carcinoma[J]. Int J Clin Oncol,2007,12(5):363‑368. DOI: 10.1007/s10147-007-0701-y.
[98] WuF, ChenB, DongD, et al. Phase 2 evaluation of neoadjuvant intensity‑modulated radiotherapy in centrally located hepatocellular carcinoma: a nonrandomized controlled trial[J]. JAMA Surg,2022,157(12):1089‑1096. DOI: 10.1001/jamasurg.2022.4702.
[99] ZhouJ, FanJ, GuF‑M, et al. A phase Ⅱ/Ⅲ study of camrelizumab plus apatinib as perioperative treatment of resectable hepatocellular carcinoma at intermediate‑high risk of recurrence: primary results of major pathologic response from phase Ⅱ stage[J]. J Clin Oncol,2023,41(16_suppl):4126. DOI: 10.1200/JCO.2023.41.16_suppl.4126.
[100] ChanA, ZhongJ, BerhaneS, et al. Development of pre and post‑operative models to predict early recurrence of hepa-tocellular carcinoma after surgical resection[J]. J Hepatol,2018,69(6):1284‑1293. DOI: 10.1016/j.jhep.2018.08.027.
[101] WuJC, HuangYH, ChauGY, et al. Risk factors for early and late recurrence in hepatitis B‑related hepatocellular carcinoma[J]. J Hepatol,2009,51(5):890‑897. DOI: 10.1016/j.jhep.2009.07.009.
[102] ImamuraH, MatsuyamaY, TanakaE, et al. Risk factors contributing to early and late phase intrahepatic recurrence of hepatocellular carcinoma after hepatectomy[J]. J Hepatol,2003,38(2):200‑207. DOI: 10.1016/s0168-8278(02)00360-4.
[103] WangZ, RenZ, ChenY, et al. Adjuvant transarterial chemoembolization for hbv‑related hepatocellular carcinoma after resection: a randomized controlled study[J]. Clin Cancer Res,2018,24(9):2074‑2081. DOI: 10.1158/1078-0432.CCR-17-2899.
[104] WeiW, JianPE, LiSH, et al. Adjuvant transcatheter arterial chemoembolization after curative resection for hepatocellular carcinoma patients with solitary tumor and microvascular invasion: a randomized clinical trial of efficacy and safety[J]. Cancer Commun (Lond),2018,38(1):61. DOI: 10.1186/s40880-018-0331-y.
[105] LiSH, MeiJ, ChengY, et al. Postoperative adjuvant hepatic arterial infusion chemotherapy with FOLFOX in hepatocellular carcinoma with microvascular invasion: a multicenter, phase Ⅲ, randomized study[J]. J Clin Oncol,2023, 41(10):1898‑1908. DOI: 10.1200/JCO.22.01142.
[106] ChenQ, ShuC, LaurenceAD, et al. Effect of Huaier granule on recurrence after curative resection of HCC: a multicentre, randomised clinical trial[J]. Gut,2018,67(11):2006-2016. DOI: 10.1136/gutjnl-2018-315983.
[107] ZhouJ, SunH, HuangZ, et al. Adjuvant lenvatinib after radi-cal resection in patients with hepatocellular carcinoma (HCC): preliminary analysis of a prospective, multi‑center, single‑arm study[R]. Shanghai, China; The Asia‑Pacific Primary Liver Cancer Expert (APPLE) Meeting,2022.
[108] ChenB, WuJX, ChengSH, et al. Phase 2 study of adjuvant radiotherapy following Narrow‑Margin hepatectomy in patients with HCC[J]. Hepatology,2021,74(5):2595‑2604. DOI: 10.1002/hep.31993.
[109] LeeJH, LeeJH, LimYS, et al. Adjuvant immunotherapy with autologous cytokine‑induced killer cells for hepatocellular carcinoma[J]. Gastroenterology,2015,148(7):1383-1391.e6. DOI: 10.1053/j.gastro.2015.02.055.
[110] HuangG, LiPP, LauWY, et al. Antiviral therapy reduces hepatocellular carcinoma recurrence in patients with low HBV‑DNA levels: a randomized controlled trial[J]. Ann Surg,2018,268(6):943‑954. DOI:10.1097/SLA.00000000 00002727.
[111] WuJ, YinZ, CaoL, et al. Adjuvant pegylated interferon therapy improves the survival outcomes in patients with hepatitis‑related hepatocellular carcinoma after curative treatment: a meta‑analysis[J]. Medicine (Baltimore),2018,97(28):e11295. DOI: 10.1097/MD.0000000000011295.
[112] QinS, ChenM, ChengAL, et al. Atezolizumab plus bevacizumab versus active surveillance in patients with resected or ablated high‑risk hepatocellular carcinoma (IMbrave050): a randomised, open‑label, multicentre, phase 3 trial[J]. Lancet,2023,402(10415):1835‑1847. DOI:10.1016/S014 0-6736(23)01796-8.
[113] TravisWD, DacicS, WistubaI, et al. IASLC multidisciplinary recommendations for pathologic assessment of lung cancer resection specimens after neoadjuvant therapy[J]. J Thorac Oncol,2020,15(5):709‑740. DOI: 10.1016/j.jtho.2020.01.005.
[114] SteinJE, LipsonEJ, CottrellTR, et al. Pan‑tumor patholo-gic scoring of response to PD‑(L)1 blockade[J]. Clin Cancer Res,2020,26(3):545‑551. DOI: 10.1158/1078-0432.CCR-19-2379.
[115] HuangC, ZhuXD, ShenYH, et al. Radiographic and α‑fetoprotein response predict pathologic complete response to immunotherapy plus a TKI in hepatocellular carcinoma: a multicenter study[J]. BMC Cancer,2023,23(1):416. DOI:10. 1186/s12885-023-10898-z.
[116] LeeYJ, LeeJM, LeeJS, et al. Hepatocellular carcinoma: dia-gnostic performance of multidetector CT and MR imaging-a systematic review and meta‑analysis[J]. Radiology,2015, 275(1):97‑109. DOI: 10.1148/radiol.14140690.
[117] SeymourL, BogaertsJ, PerroneA, et al. iRECIST: guidelines for response criteria for use in trials testing immunothera-peutics[J]. Lancet Oncol,2017,18(3):e143‑e152. DOI:10.10 16/S1470-2045(17)30074-8.
[118] XuB, DongSY, BaiXL, et al. Tumor radiomic features on pretreatment mri to predict response to lenvatinib plus an anti‑PD‑1 antibody in advanced hepatocellular carcinoma: a multicenter study[J]. Liver Cancer,2023,12(3):262-276. DOI: 10.1159/000528034.
[119] KudoM, FinnRS, QinS, et al. Lenvatinib versus sorafenib in first‑line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial[J]. Lancet,2018,391(10126):1163‑1173. DOI:10. 1016/S0140-6736(18)30207-1.
[120] QinS, BiF, GuS, et al. Donafenib versus sorafenib in first-line treatment of unresectable or metastatic hepatocellular carcinoma: a randomized, open‑label, parallel‑controlled phase Ⅱ‑Ⅲ trial[J]. J Clin Oncol,2021,39(27):3002‑3011. DOI: 10.1200/JCO.21.00163.
[121] WangDY, SalemJE, CohenJV, et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta‑analysis[J]. JAMA Oncol,2018,4(12):1721-1728. DOI: 10.1001/jamaoncol.2018.3923.
[122] XuJ, ShenJ, GuS, et al. Camrelizumab in combination with apatinib in patients with advanced hepatocellular carcinoma (RESCUE): a nonrandomized, open‑label, phase Ⅱ trial[J]. Clin Cancer Res,2021,27(4):1003‑1011. DOI:10. 1158/1078-0432.CCR-20-2571.
[123] KelleyRK, RimassaL, ChengAL, et al. Cabozantinib plus atezolizumab versus sorafenib for advanced hepatocellular carcinoma (COSMIC‑312): a multicentre, open‑label, randomised, phase 3 trial[J]. Lancet Oncol,2022,23(8):995‑1008. DOI: 10.1016/S1470-2045(22)00326-6.
[124] FinnRS, IkedaM, ZhuAX, et al. Phase Ⅰb study of lenvatinib plus pembrolizumab in patients with unresectable hepatocellular carcinoma[J]. J Clin Oncol,2020,38(26):2960-2970. DOI: 10.1200/JCO.20.00808.
[125] U.S. Department of Health and Human Services. Common Terminology Criteria for Adverse Events (CTCAE) Version 5.0[EB/OL]. (2017‑11‑27)[2023‑11‑01]. https://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcae_v5_quick_reference_5x7.pdf.
[126] 中国临床肿瘤学会(CSCO)指南工作委员会.CSCO免疫检查点抑制剂相关的毒性管理指南2021[M].北京:人民卫生出版社,2021:1‑140. [127] 中国医师协会肝癌专业委员会.肝细胞癌分子靶向药物临床应用中国专家共识(2022版)[J].中华医学杂志,2022,102(34):2655‑2668. DOI: 10.3760/cma.cn112137-20220623-01387. [128] GuoDZ, ZhangSY, DongSY, et al. Prognostic model for predicting outcome and guiding treatment decision for unresectable hepatocellular carcinoma treated with lenvatinib monotherapy or lenvatinib plus immunotherapy[J]. Front Immunol,2023,14:1141199. DOI:10.3389/fimmu.2023. 1141199.
[129] GuoDZ, ZhangSY, DongSY, et al. Circulating immune index predicting the prognosis of patients with hepatocellular carcinoma treated with lenvatinib and immunotherapy[J]. Front Oncol,2023,13:1109742. DOI:10.3389/fonc.2023. 1109742.
[130] HuangC, XuB, ZhuXD, et al. Peripheral naïve CD8+ T cells as a predictive biomarker of response to lenvatinib plus an anti‑PD‑1 antibody in advanced hepatocellular carcinoma: a biomarker study[J]. Cancer Commun (Lond),2022,42(11):1226‑1230. DOI: 10.1002/cac2.12350.
[131] BoZ, ChenB, ZhaoZ, et al. Prediction of response to lenvatinib monotherapy for unresectable hepatocellular carcinoma by machine learning radiomics: a multicenter cohort study[J]. Clin Cancer Res,2023,29(9):1730‑1740. DOI:10. 1158/1078-0432.CCR-22-2784.
[132] TadaT, KumadaT, HiraokaA, et al. Neutrophil-lymphocyte ratio predicts early outcomes in patients with unresectable hepatocellular carcinoma treated with atezolizu-mab plus bevacizumab: a multicenter analysis[J]. Eur J Gastroenterol Hepatol,2022,34(6):698‑706. DOI: 10.1097/MEG.0000000000002356.
[133] EsoY, TakedaH, TauraK, et al. Pretreatment neutrophil-to‑lymphocyte ratio as a predictive marker of response to atezolizumab plus bevacizumab for hepatocellular carcinoma[J]. Curr Oncol,2021,28(5):4157‑4166. DOI: 10.3390/curroncol28050352.
[134] OchiH, KurosakiM, JokoK, et al. Usefulness of neutrophil-to‑lymphocyte ratio in predicting progression and survival outcomes after atezolizumab‑bevacizumab treatment for hepatocellular carcinoma[J]. Hepatol Res,2023,53(1):61‑71. DOI: 10.1111/hepr.13836.
[135] MatoyaS, SuzukiT, MatsuuraK, et al. The neutrophil-to-lymphocyte ratio at the start of the second course during atezolizumab plus bevacizumab therapy predicts therapeutic efficacy in patients with advanced hepatocellular carcinoma: A multicenter analysis[J]. Hepatol Res,2023,53(6):511‑521. DOI: 10.1111/hepr.13886.
[136] WuYL, FulgenziC, D′AlessioA, et al. Neutrophil-to-lymphocyte and platelet‑to‑lymphocyte ratios as prognostic biomarkers in unresectable hepatocellular carcinoma trea-ted with atezolizumab plus bevacizumab[J]. Cancers (Basel),2022,14(23):5834. DOI: 10.3390/cancers14235834.
[137] WangJH, ChenYY, KeeKM, et al. The prognostic value of neutrophil‑to‑lymphocyte ratio and platelet-to-lymphocyte ratio in patients with hepatocellular carcinoma receiving atezolizumab plus bevacizumab[J]. Cancers (Basel),2022,14(2). DOI: 10.3390/cancers14020343.
[138] ZhuAX, AbbasAR, de GalarretaMR, et al. Molecular correlates of clinical response and resistance to atezolizumab in combination with bevacizumab in advanced hepatocellular carcinoma[J]. Nat Med,2022,28(8):1599‑1611. DOI: 10.1038/s41591-022-01868-2.
[139] ZhangW, GongC, PengX, et al. Serum concentration of CD137 and tumor infiltration by m1 macrophages predict the response to sintilimab plus bevacizumab biosimilar in advanced hepatocellular carcinoma patients[J]. Clin Cancer Res,2022,28(16):3499‑3508. DOI: 10.1158/1078-0432.CCR-21-3972.
[140] YamauchiR, ItoT, YoshioS, et al. Serum osteopontin predicts the response to atezolizumab plus bevacizumab in patients with hepatocellular carcinoma[J]. J Gastroenterol,2023,58(6):565‑574. DOI: 10.1007/s00535-023-01985-w.
[141] WangQ, XiaD, BaiW, et al. Development of a prognostic score for recommended TACE candidates with hepatocellular carcinoma: a multicentre observational study[J]. J Hepatol,2019,70(5):893‑903. DOI:10.1016/j.jhep.2019. 01.013.





 下载:
下载:

